Mendeleyev davriy tizimining ma'nosi qisqacha. Davriy tizimning ahamiyati
Elementlarning davriy tizimi kimyoning keyingi rivojlanishiga katta ta'sir ko'rsatdi. Bu nafaqat kimyoviy elementlarning birinchi tabiiy tasnifi bo'lib, ular izchil tizimni tashkil etishini va bir-biri bilan chambarchas bog'liqligini ko'rsatdi, balki keyingi tadqiqotlar uchun kuchli vosita bo'ldi.
Mendeleyev o‘zi kashf etgan davriy qonun asosida o‘z jadvalini tuzgan davrda ko‘pgina elementlar hali noma’lum edi. Shunday qilib, skandium davrining 4-elementi noma'lum edi. Atom massasi bo'yicha Cadan keyin Ti, lekin Ti ni Ca dan keyin darhol joylashtirish mumkin emas edi, chunki u 3-guruhga kirar edi, lekin Ti xususiyatlariga ko'ra uni 4-guruhga belgilash kerak. Shuning uchun Mendeleev bitta katakni o'tkazib yubordi. Xuddi shu asosda 4-davrda Zn va As o'rtasida ikkita bo'sh hujayra qoldi. Boshqa qatorlarda ham bo'sh o'rindiqlar bor edi. Mendeleev nafaqat ishonch hosil qildi bu o'rinlarni to'ldiradigan hali noma'lum elementlar bo'lishi kerak, lekin davriy tizimning boshqa elementlari orasidagi o'rnidan kelib chiqib, bunday elementlarning xususiyatlarini oldindan bashorat qilish kerak. Ushbu elementlarga ekabor nomlari berildi (chunki uning xususiyatlari borga o'xshash edi), ekaluminium, ekasilicium ..
Ga, Sc, Ge ning kashf etilishi davriy qonunning eng katta g'alabasi bo'ldi. Ayrim elementlarning valentligi va atom massalarini aniqlashda davriy tizim ham katta ahamiyatga ega edi. Xuddi shunday, davriy tizim ba'zi elementlarning atom massalarini tuzatishga turtki berdi. Masalan, ilgari Cs atom massasi 123,4 ga teng edi. Mendeleyev elementlarni jadvalga joylashtirib, uning xossalariga ko‘ra Cs Rb ostida birinchi guruhning asosiy kichik guruhida bo‘lishi kerakligini va shuning uchun atom massasi 130 ga yaqin bo‘lishini aniqladi.Zamonaviy ta’riflar Cs ning atom massasi ekanligini ko‘rsatadi. 132.9054 ni tashkil qiladi.
Va hozirda davriy qonun kimyoning etakchi yulduzi bo'lib qolmoqda. Aynan shu asosda transuran elementlari sun'iy ravishda yaratilgan. Ulardan biri, birinchi marta 1955 yilda olingan 101-sonli element buyuk rus olimi sharafiga mendelevium deb nomlangan.
Ilm-fanning keyingi rivojlanishi davriy qonunga tayangan holda materiyaning tuzilishini chuqurroq tushunishga imkon berdi. Mendeleev hayoti davomida mumkin bo'lganidan ham ko'ra.
.Yorqin tasdig'ini Mendeleevning bashoratli so'zlari topdi: "Davriy qonun halokat bilan tahdid qilinmaydi, faqat ustki tuzilma va rivojlanish va'da qilinadi".
Davriy qonunni kashf qilishning zaruriy sharti 1860 yilda Karlsrue shahrida bo'lib o'tgan kimyogarlarning xalqaro kongressining qarori bo'lib, atom va molekulyar ta'limot nihoyat o'rnatilganda, molekula va atom tushunchalarining birinchi yagona ta'riflari. shuningdek, biz hozir nisbiy atom massasi deb ataladigan atom og'irligi yasaldi.
D. I. Mendeleev o'z kashfiyotida aniq ifodalangan boshlang'ich nuqtalarga tayangan:
Barcha kimyoviy elementlar atomlarining umumiy o'zgarmas xususiyati ularning atom massasi;
Elementlarning xossalari ularning atom massalariga bog'liq;
Bu qaramlikning shakli davriydir.
Yuqorida muhokama qilingan shartlarni ob'ektiv, ya'ni olimning shaxsiyatidan mustaqil deb atash mumkin, chunki ular kimyoning fan sifatida tarixiy rivojlanishi bilan bog'liq edi.
III Davriy qonun va kimyoviy elementlarning davriy tizimi.
Mendeleyevning davriy qonunni kashf etishi.
Elementlarning davriy sistemasining birinchi varianti D. I. Mendeleyev tomonidan 1869 yilda – atom tuzilishi o‘rganilishidan ancha oldin nashr etilgan. Bu vaqtda Mendeleyev Sankt-Peterburg universitetida kimyodan dars bergan. D.I.Mendeleyev ma’ruzalarga tayyorlanar ekan, o‘zining “Kimyo asoslari” darsligi uchun material to‘plab, elementlarning kimyoviy xossalari haqidagi ma’lumotlar bir-biridan farq qiluvchi faktlar yig‘indisiga o‘xshab qolmasligi uchun materialni qanday tizimlashtirish haqida o‘ylardi.
Bu ishda D. I. Mendeleyev uchun mos yozuvlar nuqtasi elementlarning atom massalari (atom og'irliklari) edi. 1860-yilda D.I.Mendeleyev ham qatnashgan Butunjahon kimyogarlar kongressidan soʻng atom ogʻirliklarini toʻgʻri aniqlash muammosi doimiy ravishda dunyoning koʻpgina yetakchi kimyogarlari, jumladan D.I.Mendeleyevning diqqat markazida boʻldi.D. I. Mendeleyev elementlarni atom og‘irliklarining o‘sish tartibida joylashtirgan holda tabiatning asosiy qonunini kashf etdi, bu qonun hozirda davriy qonun deb ataladi:
Elementlarning xossalari ularning atom og'irligiga qarab davriy ravishda o'zgarib turadi.
Yuqoridagi formula hech bo'lmaganda zamonaviyga zid emas, unda "atom og'irligi" tushunchasi "yadro zaryadi" tushunchasi bilan almashtiriladi. Yadro proton va neytronlardan tashkil topgan. Ko'pgina elementlarning yadrolaridagi proton va neytronlar soni taxminan bir xil, shuning uchun yadrodagi protonlar soni ortishi bilan atom og'irligi ham xuddi shunday ortadi (yadro zaryadi Z).
Davriy qonunning asosiy yangiligi quyidagilar edi:
1. Xususiyatlari bo'yicha o'xshash EMAS elementlar o'rtasida aloqa o'rnatildi. Bu bog'liqlik shundan iboratki, elementlarning xossalari ularning atom og'irligi ortishi bilan bir tekis va taxminan teng ravishda o'zgaradi va keyin bu o'zgarishlar DAVRILIK TAKRORlanadi.
2. Elementlar xossalarining o'zgarishi ketma-ketligida qandaydir bog'lanish yo'qdek tuyulgan hollarda, davriy sistema hali ochilmagan elementlar bilan to'ldirilishi kerak bo'lgan GAPS uchun taqdim etilgan.
Elementlar o'rtasidagi munosabatlarni aniqlash bo'yicha oldingi barcha urinishlarda boshqa tadqiqotchilar hali kashf etilmagan elementlar uchun joy yo'q bo'lgan to'liq rasmni yaratishga harakat qilishdi. Aksincha, D. I. Mendeleev o'zining davriy sistemasining eng muhim qismini uning hali bo'sh bo'lgan hujayralari deb hisobladi. Bu hali noma'lum elementlarning mavjudligini taxmin qilish imkonini berdi.
D. I. Mendeleyev o‘z kashfiyotini ko‘pgina elementlarning atom og‘irliklari juda taxminan aniqlangan va atigi 63 ta element ma’lum bo‘lgan, ya’ni bugungi kunda bizga ma’lum bo‘lganlarning yarmidan bir oz ko‘prog‘i ma’lum bo‘lgan bir paytda qilgani hayratlanarli.
Turli elementlarning kimyoviy xossalarini chuqur bilish Mendeleyevga nafaqat hali ochilmagan elementlarga ishora qilish, balki ularning xususiyatlarini aniq bashorat qilish imkonini berdi! D. I. Mendeleyev elementning xossalarini to‘g‘ri bashorat qilgan va uni “eka-kremniy” deb atagan. 16 yildan so'ng, bu element haqiqatan ham nemis kimyogari Vinkler tomonidan topildi va germaniy deb nomlandi.
D. I. Mendeleyev tomonidan hali ochilmagan “eka-kremniy” elementi uchun bashorat qilingan xususiyatlarni germaniy (Ge) elementining xossalari bilan solishtirish. Zamonaviy davriy jadvalda germaniy "eka-kremniy" o'rnini egallaydi.
Mulk
1870 yilda D. I. Mendeleev tomonidan "eka-kremniy" uchun bashorat qilingan
1886 yilda kashf etilgan germaniy Ge uchun aniqlangan
Rang, tashqi ko'rinish
jigarrang
yorqin jigarrang
Atom og'irligi
72,59
Zichlik (g/sm3)
5,5
5,35
Oksid formulasi
XO2
GeO2
Xlorid formulasi
XCl4
GeCl4
Xloridning zichligi (g/sm3)
1,9
1,84
Xuddi shunday D.I.Mendeleyev bashorat qilgan «eka-alyuminiy» (1875-yilda kashf etilgan galliy Ga elementi) va «eka-bor» (1879-yilda kashf etilgan skandiy Sc elementi)ning xossalari ajoyib tarzda tasdiqlandi.
Shundan so‘ng D. I. Mendeleyevning davriy sistemasi nafaqat elementlarni tizimlashtirish, balki tabiatning asosiy qonuni – davriy qonunning grafik ifodasi ekanligi butun dunyo olimlariga ayon bo‘ldi.
Davriy tizimning tuzilishi.
D.I.ning davriy qonuni asosida. Mendeleyev 7 davr va 8 guruhdan iborat kimyoviy elementlarning davriy tizimini yaratdi (jadvalning qisqa davrli varianti). Hozirgi vaqtda davriy sistemaning uzoq davrli versiyasi ko'proq qo'llaniladi (7 davr, 8 guruh, elementlar - lantanidlar va aktinidlar alohida ko'rsatilgan).
Davrlar jadvalning gorizontal qatorlari bo'lib, ular kichik va katta bo'linadi. Kichik davrlarda 2 element (1-davr) yoki 8 element (2-, 3-davrlar), katta davrlarda - 18 element (4-, 5-davrlar) yoki 32 element (6-, 7-davrlar) mavjud. Har bir davr tipik metalldan boshlanadi va metall bo'lmagan (galogen) va olijanob gaz bilan tugaydi.
Guruhlar elementlarning vertikal ketma-ketligi bo'lib, ular I dan VIII gacha rim raqamlari va ruscha A va B harflari bilan raqamlangan. Davriy tizimning qisqa davrli versiyasi elementlarning kichik guruhlarini (asosiy va ikkinchi darajali) o'z ichiga olgan.
Kichik guruh - shartsiz kimyoviy analoglar bo'lgan elementlar to'plami; ko'pincha kichik guruhning elementlari guruh raqamiga mos keladigan eng yuqori oksidlanish darajasiga ega.
A-guruhlarda elementlarning kimyoviy xossalari metall bo'lmagandan metallgacha bo'lgan keng diapazonda o'zgarishi mumkin (masalan, V guruhning asosiy kichik guruhida azot metall bo'lmagan, vismut esa metalldir).
Davriy tizimda tipik metallar IA (Li-Fr), IIA (Mg-Ra) va IIIA (In, Tl) guruhlarida joylashgan. Metall bo'lmaganlar VIIA (F-Al), VIA (O-Te), VA (N-As), IVA (C, Si) va IIIA (B) guruhlarida joylashgan. A-guruhlarning ayrim elementlari (berilliy Be, alyuminiy Al, germaniy Ge, surma Sb, poloniy Po va boshqalar), shuningdek, B-guruhlarning koʻpgina elementlari ham metall, ham metall boʻlmagan xossalarni namoyon qiladi (amfoter hodisa).
Ba'zi guruhlar uchun guruh nomlari qo'llaniladi: IA (Li-Fr) - gidroksidi metallar, IIA (Ca-Ra) - gidroksidi tuproq metallari, VIA (O-Po) - xalkogenlar, VIIA (F-At) - halogenlar, VIIIA ( He-Rn ) asil gazlardir. Davriy tizimning shakli D.I. tomonidan taklif qilingan. Mendeleev qisqa muddatli yoki klassik deb nomlangan. Hozirgi vaqtda Davriy tizimning yana bir shakli ko'proq qo'llaniladi - uzoq davr.
Davriy qonun D.I. Mendeleyev va kimyoviy elementlarning davriy tizimi zamonaviy kimyoning asosiga aylandi. Nisbiy atom massalari 1983 yildagi xalqaro jadvalga muvofiq berilgan. 104-108 elementlar uchun eng uzoq umr ko'radigan izotoplarning massa raqamlari kvadrat qavs ichida berilgan. Qavslar ichida berilgan elementlarning nomlari va belgilari umuman qabul qilinmaydi.
IV Davriy qonun va atomning tuzilishi.
Atomlarning tuzilishi haqida asosiy ma'lumotlar.
19-asr oxiri - 20-asr boshlarida fiziklar atom murakkab zarracha ekanligini va oddiyroq (elementar) zarralardan iborat ekanligini isbotladilar. Kashf qilingan:
katod nurlari (ingliz fizigi J. J. Tomson, 1897), ularning zarralari elektronlar e− deb ataladi (birlik manfiy zaryadga ega);
elementlarning tabiiy radioaktivligi (frantsuz olimlari - radiokimyogarlar A. Bekkerel va M. Sklodovska-Kyuri, fizik Per Kyuri, 1896) va a-zarrachalarning mavjudligi (geliy yadrolari 4He2+);
atom markazida musbat zaryadlangan yadro mavjudligi (ingliz fizigi va radiokimyogari E. Ruterford, 1911);
bir elementni boshqa elementga sun'iy ravishda aylantirish, masalan, azotni kislorodga aylantirish (E. Ruterford, 1919). Bir element atomining yadrosidan (azot - Rezerford tajribasida) a-zarracha bilan to'qnashganda, boshqa element atomining yadrosi (kislorod) hosil bo'ladi va birlik musbat zaryadga ega bo'lgan yangi zarracha deb ataladi. proton (p+, yadro 1H)
atom yadrosida elektr neytral zarralar - neytronlarning mavjudligi n0 (ingliz fizigi J. Chadwick, 1932).
Tadqiqotlar natijasida har bir elementning atomida (1H dan tashqari) protonlar, neytronlar va elektronlar mavjudligi, proton va neytronlar esa atom yadrosida, elektronlar esa uning periferiyasida to'planganligi aniqlandi. elektron qobiq).
Yadrodagi protonlar soni atom qobig'idagi elektronlar soniga teng va bu elementning davriy tizimdagi seriya raqamiga mos keladi.
Atomning elektron qobig'i murakkab tizimdir. Turli xil energiyaga ega bo'lgan pastki qavatlarga bo'linadi (energiya darajalari); darajalar, o'z navbatida, kichik darajalarga bo'linadi va pastki darajalar shakli va o'lchamiga ko'ra farq qilishi mumkin bo'lgan atom orbitallarini o'z ichiga oladi (s, p, d, f va hokazo harflar bilan belgilanadi).
Demak, atomning asosiy xarakteristikasi atom massasi emas, balki yadroning musbat zaryadining kattaligidir. Bu atomning va shuning uchun elementning yanada umumiy va aniq tavsifidir. Elementning barcha xossalari va davriy sistemadagi holati atom yadrosining musbat zaryadining kattaligiga bog'liq. Shunday qilib, kimyoviy elementning seriya raqami raqamli ravishda uning atomi yadrosining zaryadiga to'g'ri keladi. Elementlarning davriy tizimi davriy qonunning grafik tasviri bo'lib, elementlar atomlarining tuzilishini aks ettiradi.
Atom tuzilishi nazariyasi elementlar xossalarining davriy o'zgarishini tushuntiradi. Atom yadrolarining musbat zaryadining 1 dan 110 gacha oshishi atomlardagi tashqi energiya darajasi strukturasi elementlarining davriy takrorlanishiga olib keladi. Va elementlarning xususiyatlari asosan tashqi darajadagi elektronlar soniga bog'liq bo'lganligi sababli, ular vaqti-vaqti bilan takrorlanadi. Bu davriy qonunning jismoniy ma'nosi.
Davriy tizimdagi har bir davr tashqi darajadagi atomlari bitta s-elektronga (to'liq bo'lmagan tashqi darajalarga) ega bo'lgan va shuning uchun o'xshash xususiyatlarga ega bo'lgan elementlardan boshlanadi - ular valentlik elektronlaridan osongina voz kechadilar, bu ularning metall xarakterini belgilaydi. Bu ishqoriy metallar - Li, Na, K, Rb, Cs.
Davr tashqi darajadagi atomlari 2 (s2) elektron (birinchi davrda) yoki 8 (s2p6) elektron (keyingi barchalarida) bo'lgan elementlar bilan tugaydi, ya'ni ular tugallangan tashqi darajaga ega. Bu inert xususiyatga ega bo'lgan He, Ne, Ar, Kr, Xe asil gazlardir.
1869 yilda D. I. Mendeleyev oddiy moddalar va birikmalarning xossalarini tahlil qilish asosida Davriy qonunni tuzdi: "Oddiy jismlar va elementlarning birikmalarining xossalari elementlarning atom massalarining kattaligiga davriy bog'liqdir". Davriy qonun asosida elementlarning davriy tizimi tuzilgan. Unda o'xshash xususiyatlarga ega elementlar guruhning vertikal ustunlariga birlashtirildi. Ba'zi hollarda elementlarni Davriy tizimga joylashtirishda xususiyatlarning takrorlanishining davriyligini kuzatish uchun atom massalarining ko'payishi ketma-ketligini buzish kerak edi. Masalan, tellur va yod, shuningdek, argon va kaliyni "almashtirish" kerak edi. Sababi Mendeleyev davriy qonunni atomning tuzilishi haqida hech narsa ma’lum bo‘lmagan bir davrda taklif qilgan.20-asrda atomning sayyoraviy modeli taklif qilingandan so‘ng davriy qonun quyidagicha shakllantiriladi:
"Kimyoviy elementlar va birikmalarning xossalari davriy ravishda atom yadrolarining zaryadlariga bog'liqdir".
Yadro zaryadi davriy sistemadagi element soniga va atomning elektron qavatidagi elektronlar soniga teng. Ushbu formulada Davriy qonunning "buzilishi" tushuntirildi. Davriy tizimda davr raqami atomdagi elektron sathlar soniga, asosiy kichik guruhlar elementlari uchun guruh raqami tashqi darajadagi elektronlar soniga teng.
Davriy qonunning ilmiy ahamiyati. Davriy qonun kimyoviy elementlar va ularning birikmalarining xossalarini tizimlashtirishga imkon berdi. Mendeleyev davriy sistemani tuzar ekan, hali ochilmagan ko‘plab elementlarning mavjudligini, ular uchun bo‘sh hujayralar qoldirib, ochilmagan elementlarning ko‘plab xususiyatlarini bashorat qilgan, bu ularning ochilishiga yordam bergan.Bularning birinchisi to‘rt yildan keyin sodir bo‘lgan.
Lekin nafaqat Mendeleevning yangi buyuk xizmatlarini kashf etishda.
Mendeleyev tabiatning yangi qonunini kashf etdi. Bir-biriga bog'liq bo'lmagan, bir-biriga bog'liq bo'lmagan moddalar o'rniga, fan oldidan olamning barcha elementlarini yagona bir butunga birlashtirgan yagona uyg'un tizim paydo bo'ldi, atomlar quyidagicha ko'rib chiqila boshlandi:
1. umumiy naqsh bilan organik ravishda o'zaro bog'langan,
2. atom og'irligidagi miqdoriy o'zgarishlarning ularning kimyoviy tarkibidagi sifat o'zgarishlariga o'tishini aniqlash. shaxslar,
3. metallga qarama-qarshi ekanligini ko'rsatadi. va metall bo'lmagan atomlarning xossalari ilgari o'ylanganidek mutlaq emas, faqat nisbiydir.
24. Organik kimyo rivojida strukturaviy nazariyalarning vujudga kelishi. Atom-molekulyar nazariya strukturaviy nazariyalarning nazariy asosi sifatida.
Organik kimyo. 18-asr davomida organizmlar va moddalar o'rtasidagi kimyoviy munosabatlar masalasida olimlar vitalizm ta'limotiga - hayotni koinot qonunlariga emas, balki alohida hayotiy kuchlar ta'siriga bo'ysunadigan alohida hodisa sifatida qaraydigan ta'limotni boshqargan. Bu qarash 19-asrning ko'plab olimlariga meros bo'lib o'tdi, garchi uning poydevori 1777 yilda, Lavoisier nafas olish yonish jarayoniga o'xshash jarayon ekanligini ta'kidlaganida silkingan.
1828 yilda nemis kimyogari Fridrix Wöhler (1800-1882) ammoniy siyanatni isitib (bu birikma so'zsiz noorganik modda deb hisoblangan) odamlar va hayvonlarning chiqindilari bo'lgan karbamidni oldi. 1845 yilda Wöhlerning shogirdi Adolf Kolbe boshlang'ich elementlardan uglerod, vodorod va kisloroddan sirka kislotasini sintez qildi. 18-asrning 50-yillarida fransuz kimyogari Per Bertelo organik birikmalar sintezi boʻyicha tizimli ishlarni boshlab, metil va etil spirtlari, metan, benzol, asetilenni oldi. Tabiiy organik birikmalarni tizimli o'rganish shuni ko'rsatdiki, ularning barchasi bir yoki bir nechta uglerod atomlarini o'z ichiga oladi va juda ko'p vodorod atomlarini o'z ichiga oladi. Tip nazariyasi. Ko'p sonli murakkab uglerod o'z ichiga olgan birikmalarning topilishi va izolyatsiyasi ularning molekulalarining tarkibi haqidagi savolni keskin ko'tardi va mavjud tasnif tizimini qayta ko'rib chiqish zarurligiga olib keldi. 1840-yillarga kelib, kimyogarlar Berzeliusning dualistik g'oyalari faqat noorganik tuzlarga taalluqli ekanligini tushunishdi. 1853 yilda barcha organik birikmalarni turlari bo'yicha tasniflashga harakat qilindi. Umumlashtirilgan “turlar nazariyasi” fransuz kimyogari tomonidan taklif qilingan Charlz Frederik Jerard, ular atomlarning turli guruhlarining assotsiatsiyasi bu guruhlarning elektr zaryadlari bilan emas, balki ularning o'ziga xos kimyoviy xossalari bilan belgilanadi deb hisoblagan.
Strukturaviy kimyo. 1857 yilda Kekule valentlik nazariyasiga asoslanib (valentlik deganda ma'lum bir elementning bir atomi bilan birlashadigan vodorod atomlari soni tushuniladi) uglerod to'rt valentli va shuning uchun boshqa to'rtta atom bilan birlashib, uzun zanjirlar hosil qilishi mumkinligini aytdi. - tekis yoki tarvaqaylab ketgan. Shuning uchun organik molekulalar radikallar birikmasi sifatida emas, balki tuzilish formulalari - atomlar va ular orasidagi bog'lar sifatida tasvirlana boshladi.
1874 yilda daniyalik kimyogar Jeykob Van't Xoff va frantsuz kimyogari Jozef Axil Le Bel (1847-1930) bu fikrni kosmosda atomlarning joylashishiga qadar kengaytirdi. Ular molekulalar tekis emas, balki uch o'lchamli tuzilmalar ekanligiga ishonishgan. Bu kontseptsiya fazoviy izomeriya, bir xil tarkibga ega, ammo har xil xususiyatlarga ega bo'lgan molekulalarning mavjudligi kabi ko'plab taniqli hodisalarni tushuntirishga imkon berdi. Ma'lumotlar juda mos keladi. Lui Paster tartarik kislotaning izomerlari haqida.
6. Davriy qonun va davriy sistema d.I. Mendeleyev Davriy sistemaning tuzilishi (davr, guruh, kichik guruh). Davriy qonun va davriy tizimning ma'nosi.
Davriy D.I. qonuni Mendeleyev:Oddiy jismlarning xossalari, shuningdek birikmalarning shakllari va xossalarielementlar davriy bog'liqlikda bo'ladielementlarning atom og'irliklarining qiymatlari (Elementlarning xossalari ularning yadrolari atomlarining zaryadiga davriy bog'liqdir).
Elementlarning davriy tizimi. Xususiyatlari ketma-ket o'zgarib turadigan elementlar qatori, masalan, litiydan neongacha yoki natriydan argongacha bo'lgan sakkiz elementdan iborat qator, Mendeleev davrlar deb atagan. Agar natriy litiy ostida, argon esa neon ostida bo'lishi uchun bu ikki davrni bir-birining ostiga yozsak, elementlarning quyidagi tartibini olamiz:
Ushbu tartibga solish bilan o'z xususiyatlariga o'xshash va bir xil valentlikka ega bo'lgan elementlar, masalan, litiy va natriy, berilliy va magniy va boshqalar vertikal ustunlarga tushadi.
Barcha elementlarni davrlarga bo'lib, bir davrni ikkinchi davr ostida joylashtirgan holda xossalari va hosil bo'lgan birikmalar turi bo'yicha bir-biriga o'xshash elementlar bir-birining ostiga tushishi uchun Mendeleyev jadval tuzib, uni elementlarning davriy sistemasini guruhlar va qatorlar bo'yicha deb atagan.
Davriy tizimning qiymatiBiz. Elementlarning davriy tizimi kimyoning keyingi rivojlanishiga katta ta'sir ko'rsatdi. Bu nafaqat kimyoviy elementlarning birinchi tabiiy tasnifi bo'lib, ular izchil tizimni tashkil etishini va bir-biri bilan chambarchas bog'liqligini ko'rsatdi, balki keyingi tadqiqotlar uchun kuchli vosita bo'ldi.
7. Kimyoviy elementlar xossalarining davriy o'zgarishi. Atom va ion radiuslari. Ionizatsiya energiyasi. Elektronga yaqinlik. Elektromanfiylik.
Atom radiuslarining Z atom yadrosining zaryadiga bog'liqligi davriy xarakterga ega. Bir davr ichida Z ning ortishi bilan atom hajmining qisqarish tendentsiyasi kuzatiladi, bu ayniqsa qisqa davrlarda aniq kuzatiladi.
Yadrodan uzoqroq bo'lgan yangi elektron qatlamining qurilishi boshlanishi bilan, ya'ni keyingi davrga o'tishda atom radiuslari ortadi (masalan, ftor va natriy atomlarining radiuslarini solishtiring). Natijada, kichik guruh ichida yadro zaryadi ortishi bilan atomlarning o'lchamlari ortadi.
Elektron atomlarining yo'qolishi uning samarali hajmining pasayishiga, ortiqcha elektronlarning qo'shilishi esa ko'payishiga olib keladi. Shuning uchun musbat zaryadlangan ion (kation) ning radiusi doimo kichik, manfiy zaryadlangan bo'lmagan (anion) radiusi esa mos keladigan elektr neytral atomning radiusidan doimo katta bo'ladi.
Bir kichik guruh ichida bir xil zaryadli ionlarning radiuslari yadro zaryadining ortishi bilan ortadi.Bu qonuniyat elektron qatlamlar sonining ortishi va tashqi elektronlarning yadrodan uzoqlashishi bilan izohlanadi.
Metalllarning eng xarakterli kimyoviy xossasi ularning atomlarining tashqi elektronlardan osonlikcha voz kechib, musbat zaryadlangan ionlarga aylanish qobiliyatidir, metall bo'lmaganlar esa, aksincha, manfiy ionlar hosil qilish uchun elektronlarni biriktirish qobiliyati bilan tavsiflanadi. Elektronni atomdan musbat ionga aylantirgan holda ajratish uchun ionlanish energiyasi deb ataladigan energiyani sarflash kerak.
Ionlanish energiyasini atomlarni elektr maydonida tezlashtirilgan elektronlar bilan bombardimon qilish orqali aniqlash mumkin. Elektron tezligi atomlarning ionlanishi uchun etarli bo'lgan eng kichik maydon kuchlanishi ma'lum element atomlarining ionlanish potentsiali deb ataladi va voltlarda ifodalanadi. Etarli energiya sarflanganda, atomdan ikki, uch yoki undan ortiq elektronni yirtib tashlash mumkin. Shuning uchun ular birinchi ionlanish potentsiali (birinchi elektronning atomidan ajralib chiqish energiyasi) ikkinchi ionlanish potensiali (ikkinchi elektronning ajralish energiyasi) haqida gapiradi.
Yuqorida ta'kidlab o'tilganidek, atomlar nafaqat ehson qilishlari, balki elektronlarni ham qo'shishlari mumkin. Elektron erkin atomga biriktirilganda ajralib chiqadigan energiya atomning elektronga yaqinligi deb ataladi. Elektronga yaqinlik, xuddi ionlanish energiyasi kabi, odatda elektronvoltlarda ifodalanadi. Shunday qilib, vodorod atomining elektronga yaqinligi 0,75 eV, kislorod - 1,47 eV, ftor - 3,52 eV.
Metall atomlarining elektronga yaqinligi odatda nolga yaqin yoki manfiy; bundan kelib chiqadiki, ko'pchilik metallarning atomlari uchun elektronlarning qo'shilishi energetik jihatdan noqulaydir. Metall bo'lmagan atomlarning elektronga yaqinligi har doim ijobiy bo'ladi va qanchalik katta bo'lsa, nometall davriy tizimda nometall gazga qanchalik yaqin bo'lsa; bu davr oxiriga yaqinlashganda metall bo'lmagan xususiyatlarning o'sishini ko'rsatadi.
Noma'lum elementlarni ilmiy bashorat qilish imkoniyati davriy qonun va elementlarning davriy sistemasi kashf etilgandan keyingina haqiqatga aylandi. D. I. Mendeleyev 11 ning mavjudligini bashorat qilgan yangi elementlar: ekabor, ekasilikon, ekaalyuminiy va boshqalar Davriy tizimdagi elementning "koordinatalari" (seriya raqami, guruhi va davri) atom massasini, shuningdek, bashorat qilingan elementning eng muhim xususiyatlarini taxminan taxmin qilish imkonini berdi. Ushbu bashoratlarning aniqligi, ayniqsa, bashorat qilingan element ma'lum va etarlicha o'rganilgan elementlar bilan o'ralganida ortdi.
Buning sharofati bilan 1875 yilda Fransiyada L. de Boisboran galliyni (ekaalyuminiy) ochdi; 1879 yilda L. Nilson (Shvetsiya) skandiyni (ekabor) kashf etdi; 1886 yilda Germaniyada K.Vinkler germaniyni (ekasilikon) kashf etdi.
To'qqizinchi va o'ninchi qatorlarning ochilmagan elementlariga kelsak, D. I. Mendeleevning bayonotlari ko'proq ehtiyotkor edi, chunki ularning xususiyatlari juda yomon o'rganilgan. Shunday qilib, oltinchi davr tugagan vismutdan keyin ikkita chiziqcha qoldi. Ulardan biri tellurning analogiga to'g'ri keldi, ikkinchisi noma'lum og'ir halogenga tegishli edi. Ettinchi davrda faqat ikkita element - toriy va uran ma'lum edi. D. I. Mendeleyev toriydan oldingi birinchi, ikkinchi va uchinchi guruh elementlariga tegishli boʻlishi kerak boʻlgan tire bilan bir nechta katakchalarni qoldirdi. Toriy va uran o'rtasida bo'sh qafas ham qolgan. Uran uchun beshta bo'sh joy qoldirildi, ya'ni. deyarli 100 yil o'tgach, transuran elementlari ko'zda tutilgan.
To'qqizinchi va o'ninchi qator elementlariga oid D.I.Mendeleevning bashoratlarining to'g'riligini tasdiqlash uchun biz poloniy bilan misol keltirishimiz mumkin (seriya raqami 84). Atom raqami 84 bo'lgan elementning xossalarini bashorat qilgan D. I. Mendeleev uni tellurning analogi deb belgilab, uni ditellur deb atadi. Bu element uchun u 212 atom massasini va EO e tipidagi oksid hosil qilish qobiliyatini qabul qildi. Ushbu element 9,3 g / sm 3 zichlikka ega bo'lishi va past eriydigan, kristalli va uchuvchan bo'lmagan kulrang metall bo'lishi kerak. Faqat 1946 yilda sof shaklda olingan poloniy yumshoq, eruvchan, kumush rangli metall bo'lib, zichligi 9,3 g / sm 3 ni tashkil qiladi. Uning xossalari tellurnikiga o'xshaydi.
D. I. Mendeleyevning davriy qonuni tabiatning eng muhim qonunlaridan biri bo'lib, alohida ahamiyatga ega. Elementlar o'rtasida mavjud bo'lgan tabiiy munosabatlarni, materiyaning oddiydan murakkabgacha rivojlanish bosqichlarini aks ettirgan bu qonun zamonaviy kimyoga asos soldi. Uning kashfiyoti bilan kimyo tavsiflovchi fan bo'lishni to'xtatdi.
D. I. Mendeleyevning davriy qonuni va elementlar tizimi dunyoni bilishning ishonchli usullaridan biridir. Elementlar umumiy xususiyat yoki tuzilish bilan birlashganligi sababli, bu hodisalarning o'zaro bog'liqligi va o'zaro bog'liqligi qonuniyatlarini ko'rsatadi.
Barcha elementlar birgalikda eng oddiy vodoroddan 118-elementgacha bo'lgan doimiy rivojlanishning bir chizig'ini tashkil qiladi. Bunday qolipni birinchi marta D. I. Mendeleyev payqagan va u yangi elementlarning mavjudligini bashorat qilishga muvaffaq bo'lgan va shu orqali materiyaning rivojlanishining uzluksizligini ko'rsatgan.
Elementlar va ularning birikmalarini guruhlar ichidagi xossalarini taqqoslab, miqdoriy o'zgarishlarning sifatga o'tish qonunining namoyon bo'lishini osongina aniqlash mumkin. Shunday qilib, har qanday davrda odatiy metalldan odatiy metall bo'lmaganga (galogen) o'tish sodir bo'ladi, ammo galogendan keyingi davrning birinchi elementiga (ishqoriy metall) o'tish xossalarning paydo bo'lishi bilan birga keladi. bu halogenga keskin qarama-qarshidir. D. I. Mendeleyevning kashfiyoti atomning tuzilishi haqidagi nazariyaga aniq va ishonchli asos yaratdi, materiyaning tabiati haqidagi barcha zamonaviy bilimlarning rivojlanishiga katta ta'sir ko'rsatdi.
D. I. Mendeleyevning davriy sistemani yaratish boʻyicha ishi yangi kimyoviy elementlarni maqsadli izlashning ilmiy asoslangan usulining boshlanishi boʻldi. Bunga zamonaviy yadro fizikasining ko'plab yutuqlari misol bo'la oladi. O'tgan yarim asrda 102-118 seriya raqamlari bo'lgan elementlar sintez qilindi. Kimyoviy elementlar o'rtasidagi munosabatlarning qonuniyatlarini bilmasdan turib, ularning xususiyatlarini o'rganish va olish mumkin emas.
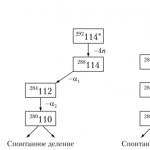
Bunday bayonotga dalil natijalar 114, 116, 118 elementlarning sintezi bo'yicha tadqiqotlar.
114-elementning izotopi plutoniyning 48Ca izotopi bilan, 116-izotop esa kuriyning 48Ca izotopi bilan oʻzaro taʼsiridan olingan:
Olingan izotoplarning barqarorligi shunchalik yuqoriki, ular o'z-o'zidan bo'linmaydi, balki alfa parchalanishiga uchraydi, ya'ni. alfa zarrachalarining bir vaqtning o'zida emissiyasi bilan yadroning bo'linishi.
Olingan eksperimental ma'lumotlar nazariy hisob-kitoblarni to'liq tasdiqlaydi: ketma-ket alfa parchalanishi natijasida 112 va 110 elementlarning yadrolari hosil bo'ladi, shundan so'ng o'z-o'zidan bo'linish boshlanadi:

Elementlarning xossalarini solishtirsak, ular umumiy strukturaviy xususiyatlar bilan o'zaro bog'langanligiga amin bo'lamiz. Shunday qilib, tashqi va tashqi elektron qobiqlarning tuzilishini taqqoslab, berilgan elementga xos bo'lgan barcha turdagi birikmalarni yuqori aniqlik bilan bashorat qilish mumkin. Bunday aniq munosabatlar 104-element - ruterfordiy misolida juda yaxshi tasvirlangan. Kimyogarlar, agar bu element gafniyning (72 Hf) analogi bo'lsa, uning tetraklorid xossalari taxminan HfCl 4 bilan bir xil bo'lishi kerakligini taxmin qilishdi. Eksperimental kimyoviy tadqiqotlar nafaqat kimyogarlarning prognozini, balki yangi o'ta og'ir element 1 (M Rf. Xuddi shu o'xshashlikni xususiyatlarda kuzatish mumkin - Os (Z = 76) va Ds (Z = 110) - ikkalasining ham kashf etilishini tasdiqladi. elementlar R0 4 tipidagi uchuvchi oksidlarni hosil qiladi.Bularning barchasi haqida gapiradi hodisalarning o'zaro bog'liqligi va o'zaro bog'liqligi qonunining namoyon bo'lishi.
Elementlarning xossalarini guruhlar ichida ham, davrlarda ham solishtirish va ularni atom tuzilishi bilan solishtirish qonunni ko'rsatadi. miqdordan sifatga o'tish. Miqdoriy o'zgarishlarning sifatga o'tishi faqat mumkin orqaliinkorni inkor qilish. Davrlar ichida yadro zaryadining oshishi bilan ishqoriy metalldan asil gazga o'tish sodir bo'ladi. Keyingi davr yana ishqoriy metall bilan boshlanadi - undan oldingi olijanob gazning xususiyatlarini butunlay inkor etadigan element (masalan, He va Li; Ne va Na; Ar va Kr va boshqalar).
Har bir davrda keyingi element yadrosining zaryadi oldingisiga nisbatan bir marta ortadi. Bu jarayon vodoroddan 118-elementgacha kuzatiladi va ko'rsatadi materiya rivojlanishining uzluksizligi.
Nihoyat, atomda qarama-qarshi zaryadlarning (proton va elektron) birikmasi, metall va metall bo'lmagan xususiyatlarning namoyon bo'lishi, amfoter oksidlar va gidroksidlarning mavjudligi qonunning ko'rinishidir. qarama-qarshiliklarning birligi va kurashi.
Shuni ham ta'kidlash kerakki, davriy qonunning ochilishi materiyaning xususiyatlariga oid fundamental tadqiqotlarning boshlanishi edi.
Niels Bor ta'biri bilan aytganda, davriy tizim "kimyo, fizika, mineralogiya va texnologiya sohasidagi tadqiqotlar uchun etakchi yulduzdir".
- 112, 114, 116, 118 elementlar Birlashgan yadroviy tadqiqotlar institutida (Dubna, Rossiya) olingan. 113 va 115-elementlar rus va amerikalik fiziklar tomonidan birgalikda olingan. Materialni Rossiya Fanlar akademiyasining akademigi Yu.Ts.Oganesyan xushmuomalalik bilan taqdim etdi.