Менделеев жүйесінің периодтық заңының мәні. Периодтық жүйенің мәні және периодтық заң D
1869 жылы Д.И.Менделеев жай заттар мен қосылыстардың қасиеттерін талдау негізінде Периодтық заңды тұжырымдады: «Қарапайым денелер мен элементтер қосылыстарының қасиеттері элементтердің атомдық массаларының шамасына периодты тәуелділікте болады».Периодтық заң негізінде элементтердің периодтық жүйесі құрастырылды. Онда ұқсас қасиеттері бар элементтер топтың тік бағандарына біріктірілді. Кейбір жағдайларда элементтерді Периодтық жүйеге орналастырған кезде қасиеттердің қайталану кезеңділігін байқау үшін атомдық массалардың өсу ретін бұзу қажет болды. Мысалы, теллур мен йодты, сондай-ақ аргон мен калийді «ауыстыруға» тура келді. Себебі, Менделеев периодтық заңды атомның құрылысы туралы ештеңе білмейтін кезеңде ұсынған.20 ғасырда атомның планетарлық моделі ұсынылғаннан кейін периодтық заң былай тұжырымдалады:
«Химиялық элементтер мен қосылыстардың қасиеттері атом ядроларының зарядтарына периодты тәуелділікте болады».
Ядроның заряды периодтық жүйедегі элемент санына және атомның электрондық қабатындағы электрондар санына тең. Бұл тұжырымда мерзімді заңның «бұзылуы» түсіндірілді. Периодтық жүйеде период нөмірі атомдағы электрондық деңгейлер санына тең, негізгі топшалар элементтері үшін топ нөмірі сыртқы деңгейдегі электрондар санына тең.
Периодтық заңның ғылыми маңызы. Периодтық заң химиялық элементтер мен олардың қосылыстарының қасиеттерін жүйелеуге мүмкіндік берді. Периодтық жүйені құрастыру кезінде Менделеев әлі ашылмаған көптеген элементтердің болуын болжаған, олар үшін бос жасушалар қалдырған және ашылмаған элементтердің көптеген қасиеттерін болжаған, бұл олардың ашылуын жеңілдеткен.Олардың біріншісі төрт жылдан кейін пайда болды.
Бірақ Менделеевтің жаңа ұлы еңбегін ашуда ғана емес.
Менделеев табиғаттың жаңа заңын ашты. Бір-біріне ұқсамайтын, бір-бірімен байланысы жоқ субстанциялардың орнына, ғылым алдында Әлемнің барлық элементтерін біртұтас тұтастыққа біріктіретін біртұтас үйлесімді жүйе пайда болды, атомдар келесідей қарастырыла бастады:
1. ортақ заңдылықпен органикалық түрде өзара байланысты,
2. атомдық салмақтағы сандық өзгерістердің олардың химиялық құрамының сапалық өзгерістеріне ауысуын анықтау. тұлғалар,
3. металға қарама-қарсы екенін көрсетеді. және металл емес атомдардың қасиеттері бұрын ойлағандай абсолютті емес, тек салыстырмалы.
24. Органикалық химияның дамуындағы құрылымдық теориялардың пайда болуы. Атом-молекулалық теория құрылымдық теориялардың теориялық негізі ретінде.
Органикалық химия.Бүкіл 18 ғасыр бойы организмдер мен заттардың арасындағы химиялық байланыстар мәселесінде ғалымдар өмірді ғалам заңдарына емес, ерекше тіршілік күштерінің ықпалына бағынатын ерекше құбылыс ретінде қарастыратын витализм туралы ілімді басшылыққа алды. Бұл көзқарас 19-ғасырдың көптеген ғалымдарына мұра болды, бірақ оның іргетасы 1777 жылы Лавуазье тыныс алуды жануға ұқсас процесс деп ұсынған кезде шайқалған.
1828 жылы неміс химигі Фридрих Вёлер (1800–1882) аммоний цианатын қыздыра отырып (бұл қосылыс сөзсіз бейорганикалық зат болып саналды), адам мен жануарлардың қалдық өнімі мочевина алды. 1845 жылы Вёлердің шәкірті Адольф Кольбе бастапқы элементтерден көміртегі, сутегі және оттегіден сірке қышқылын синтездеді. 1850 жылдары француз химигі Пьер Бертело органикалық қосылыстарды синтездеу бойынша жүйелі жұмысты бастап, метил және этил спирттерін, метан, бензол, ацетиленді алды. Табиғи органикалық қосылыстарды жүйелі түрде зерттеу олардың барлығында бір немесе бірнеше көміртек атомдары және өте көп сутегі атомдары бар екенін көрсетті. Түр теориясы. Күрделі көміртегі бар қосылыстардың үлкен санын табу және оқшаулау олардың молекулаларының құрамы туралы мәселені күрт көтерді және қолданыстағы жіктеу жүйесін қайта қарау қажеттілігіне әкелді. 1840 жылдары химиктер Берцелиустың дуалистік идеялары бейорганикалық тұздарға ғана қатысты екенін түсінді. 1853 жылы барлық органикалық қосылыстарды түрі бойынша жіктеуге әрекет жасалды. Жалпылама «түрлер теориясын» француз химигі ұсынған Чарльз Фредерик Джерард, олар атомдардың әртүрлі топтарының ассоциациясы осы топтардың электр зарядымен емес, олардың ерекше химиялық қасиеттерімен анықталады деп есептеді.
Құрылымдық химия. 1857 жылы Кекуле валенттілік теориясына сүйене отырып (валенттілік бойынша берілген элементтің бір атомымен қосылатын сутегі атомдарының саны түсіндірілді) көміртегі төрт валентті, сондықтан басқа төрт атоммен қосылып, ұзын тізбектер құра алады деген болжам жасады. - түзу немесе тармақталған. Сондықтан органикалық молекулалар радикалдардың қосындысы ретінде емес, құрылымдық формулалар – атомдар және олардың арасындағы байланыстар ретінде бейнелене бастады.
1874 жылы дат химигі Джейкоб вант Хоффжәне француз химигі Джозеф Ахилле Ле Бель (1847–1930) бұл идеяны атомдардың кеңістіктегі орналасуына дейін кеңейтті. Олар молекулалар жазық емес, үш өлшемді құрылымдар деп есептеді. Бұл тұжырымдама кеңістіктік изомерия, құрамы бірдей, бірақ қасиеттері әртүрлі молекулалардың болуы сияқты көптеген белгілі құбылыстарды түсіндіруге мүмкіндік берді. Деректер өте жақсы сәйкес келеді. Луи Пастершарап қышқылының изомерлері туралы.
100 рбірінші тапсырыс бонусы
Жұмыс түрін таңдау Бітіру жұмысы Курстық жұмыс Конспект Магистрлік жұмыс Практика бойынша есеп Мақала Есеп Қайталау Тест жұмысы Монография Есептер шығару Бизнес жоспар Сұрақтарға жауап Шығармашылық жұмыс Эссе Сурет салу Композициялар Аударма Презентация Теру Басқа Мәтіннің бірегейлігін арттыру Кандидаттық диссертация Зертханалық жұмыс Анықтама бойынша- түзу
Бағасын сұраңыз
Элементтердің периодтық жүйесінің бірінші нұсқасын Дмитрий Иванович Менделеев 1869 жылы – атомның құрылымы зерттелмей тұрып көп уақыт бұрын шығарған. Бұл жұмыста Д.И.Менделеев үшін анықтамалық нүкте элементтердің атомдық массалары (атомдық салмақтары) болды. Элементтерді атомдық массаларының өсу ретімен орналастыра отырып, Д.И.Менделеев табиғаттың іргелі заңын ашты, ол қазір периодтық заң деп аталады: Элементтердің қасиеттері олардың атомдық салмағына сәйкес периодты түрде өзгереді.
Д.И.Менделеев ашып, тұжырымдаған периодтық заңның іргелі жаңалығы төмендегідей болды:
1. Қасиеттері бойынша ҰҚСАҚ ЕМЕС элементтер арасында байланыс орнатылды. Бұл қатынас элементтердің қасиеттері олардың атомдық салмағының ұлғаюымен біркелкі және шамамен бірдей өзгеретіндігінде, содан кейін бұл өзгерістер МЕЗІМДІ ҚАЙТАланып отыратынында жатыр.
2. Элементтердің қасиеттерінің өзгеру тізбегінде қандай да бір сілтемелер жоқ болып көрінетін жағдайларда, периодтық жүйе әлі ашылмаған элементтермен толтырылуы керек болатын GAPS үшін қарастырылған. Сонымен қатар, периодтық заң бұл элементтердің қасиеттерін болжауға мүмкіндік берді.
Элементтер арасындағы байланысты анықтаудың барлық алдыңғы әрекеттерінде басқа зерттеушілер әлі ашылмаған элементтерге орын жоқ толық суретті жасауға ұмтылды.
Д.И.Менделеевтің ашқан жаңалығын көптеген элементтердің атомдық массалары өте шамамен анықталып, тек 63 элемент белгілі болған кезде ашқаны таңданарлық жайт, яғни қазіргі бізге мәлімдердің жартысынан сәл астамы.
Менделеев бойынша периодтық заң: «Жай денелердің қасиеттері... және элементтер қосылыстары элементтердің атомдық массаларының шамасына периодтық тәуелділікте болады».
Периодтық заң негізінде элементтердің периодтық жүйесі құрастырылды. Онда ұқсас қасиеттері бар элементтер топтың тік бағандарына біріктірілді. Кейбір жағдайларда элементтерді Периодтық жүйеге орналастырған кезде қасиеттердің қайталану кезеңділігін байқау үшін атомдық массалардың өсу ретін бұзу қажет болды. Мысалы, теллур мен йодты, сондай-ақ аргон мен калийді «ауыстыруға» тура келді.
Дегенмен, химиктердің атомдық салмақтарды түзету бойынша орасан зор және мұқият жұмысынан кейін де, периодтық жүйенің төрт жерінде элементтер атомдық массаны арттырудағы қатаң орналасу тәртібін «бұзады».
Д.И.Менделеев кезінде мұндай ауытқулар Периодтық жүйенің кемшіліктері деп саналды. Атом құрылымының теориясы бәрін өз орнына қойды: элементтер өте дұрыс орналасқан - олардың ядроларының зарядтарына сәйкес. Олай болса, аргонның атомдық салмағы калийдің атомдық салмағынан үлкен екенін қалай түсіндіруге болады?
Кез келген элементтің атомдық салмағы оның барлық изотоптарының табиғаттағы көптігін ескере отырып, олардың орташа атомдық салмағына тең. Кездейсоқ, аргонның атомдық салмағы ең «ауыр» изотоппен анықталады (ол табиғатта көп мөлшерде кездеседі). Калий, керісінше, оның «жеңілірек» изотопы (яғни массалық саны төмен изотоп) басым болады.
Себебі, Менделеев периодтық заңды атомның құрылысы туралы ештеңе білмейтін кезеңде ұсынған. 20 ғасырда атомның планетарлық моделі ұсынылғаннан кейін периодтық заң келесідей тұжырымдалған:
«Химиялық элементтер мен қосылыстардың қасиеттері атом ядроларының зарядтарына периодты тәуелділікте болады».
Ядроның заряды периодтық жүйедегі элемент санына және атомның электрондық қабатындағы электрондар санына тең. Бұл тұжырымда мерзімді заңның «бұзылуы» түсіндірілді. Периодтық жүйеде период нөмірі атомдағы электрондық деңгейлер санына тең, негізгі топшалар элементтері үшін топ нөмірі сыртқы деңгейдегі электрондар санына тең.
Химиялық элементтердің қасиеттерінің периодты түрде өзгеруінің себебі - электронды қабаттардың периодты толтырылуы. Келесі қабықты толтырғаннан кейін жаңа кезең басталады. Элементтердің периодты өзгеруі оксидтердің құрамы мен қасиеттерінің өзгеруінен анық көрінеді.
Периодтық заңның ғылыми маңызы.
Периодтық заң химиялық элементтер мен олардың қосылыстарының қасиеттерін жүйелеуге мүмкіндік берді. Периодтық жүйені құрастырған кезде Менделеев әлі ашылмаған көптеген элементтердің бар екендігін болжаған, олар үшін бос жасушалар қалдырған және ашылмаған элементтердің көптеген қасиеттерін болжаған, бұл олардың ашылуын жеңілдеткен. Олардың біріншісі төрт жылдан кейін пайда болды. Менделеевтің орны мен қасиетін қалдырған, атомдық салмағын болжаған элемент кенеттен пайда болды! Жас француз химигі Лекок де Бусборан Париж Ғылым академиясына хат жолдады. Онда былай делінген:<Позавчера, 27 августа 1875 года, между двумя и четырьмя часами ночи я обнаружил новый элемент в минерале цинковая обманка из рудника Пьерфитт в Пиренеях>. Бірақ ең таңғаларлық нәрсе әлі алда еді. Менделеев бұл элементке орын қалдыра отырып, оның тығыздығы 5,9 болуы керек деп болжады. Ал Буйсбодран мәлімдеген: ол ашқан элементтің тығыздығы 4,7. Көзінен жаңа элементті көрмеген Менделеев – бұл одан да таңғаларлық – француз химигі есептеулерде қателік жібергенін айтты. Бірақ Бойсбодран да қыңыр болып шықты: ол дәл екеніне сендірді. Біраз уақыттан кейін қосымша өлшеулерден кейін Менделеевтің сөзсіз дұрыс екендігі анықталды. Кестедегі бос орынды толтырған бірінші элемент Буйсборан өзінің отаны Францияның құрметіне галлийді атады. Сосын оған осы элементтің бар екенін болжаған, химияның даму жолын біржолата белгілеген адамның атын беру ешкімнің ойына да келмеген. Мұны ХХ ғасырдың ғалымдары жасады. Менделеевтің есімі кеңестік физиктер ашқан элемент.
Бірақ Менделеевтің жаңа ұлы еңбегін ашуда ғана емес.
Менделеев табиғаттың жаңа заңын ашты. Бір-біріне ұқсамайтын, бір-бірімен байланысы жоқ субстанциялардың орнына ғылым алдында Әлемнің барлық элементтерін біртұтас тұтастыққа біріктіретін біртұтас үйлесімді жүйе пайда болды, атомдар келесідей қарастырыла бастады:
1. ортақ заңдылықпен органикалық түрде өзара байланысты,
2. атомдық салмақтағы сандық өзгерістердің олардың химиялық құрамының сапалық өзгерістеріне ауысуын анықтау. тұлғалар,
3. атомдардың металдық және бейметалдық қасиеттері арасындағы қарама-қайшылықтың бұрын ойлағандай абсолютті емес, тек салыстырмалы екенін көрсетеді.
Барлық элементтер арасындағы, олардың физикалық және химиялық қасиеттері арасындағы өзара байланысты ашу үлкен маңызға ие ғылыми-философиялық мәселе қойды: бұл өзара байланысты, осы бірлікті түсіндіру керек.
Менделеевтің зерттеулері атомның құрылымын түсіндіру әрекеттеріне берік және сенімді негіз берді: периодтық заң ашылғаннан кейін барлық элементтердің атомдары «бір жоспар бойынша» салынуы керек екендігі, олардың құрылымы элементтердің қасиеттерінің периодтылығын көрсетеді.
Атомның сол моделі ғана тануға және дамуға құқылы еді, бұл ғылымды периодтық жүйедегі элементтің орнының жұмбақтарын түсінуге жақындатады. Біздің ғасырымыздың ұлы ғалымдары осы үлкен мәселені шеше отырып, атомның құрылымын ашты - сондықтан Менделеев заңы материяның табиғаты туралы барлық заманауи білімдердің дамуына орасан зор әсер етті.
Қазіргі химияның барлық жетістіктері, атомдық және ядролық физиканың, соның ішінде атом энергиясы мен жасанды элементтер синтезінің табыстары периодтық заңның арқасында ғана мүмкін болды. Өз кезегінде атомдық физиканың табыстары, жаңа зерттеу әдістерінің пайда болуы, кванттық механиканың дамуы периодтық заңның мәнін кеңейтіп, тереңдете түсті.
Өткен ғасырда табиғаттың шынайы заңы – Менделеев заңы ескіріп қана қойған жоқ және өзінің маңызын жойған жоқ. Керісінше, ғылымның дамуы оның мән-мағынасының әлі толық білінбегенін және аяқталмағанын, оның жаратушы елестеткеннен, ғалымдардың соңғы кезге дейін ойлағаннан әлдеқайда кең екенін көрсетті. Атомның сыртқы электрондық қабаттарының құрылымы ғана емес, атом ядроларының жұқа құрылымы да периодтылық заңына бағынатыны соңғы уақытта анықталды. Шамасы, күрделі және көп жағынан қарапайым бөлшектердің түсініксіз әлемін басқаратын заңдылықтар да олардың негізінде периодтық сипатқа ие.
Химия мен физиканың одан әрі ашылуы Периодтық заңның негізгі мағынасын бірнеше рет растады. Периодтық жүйеге өте жақсы сәйкес келетін инертті газдар табылды - бұл әсіресе кестенің ұзын пішіні арқылы анық көрінеді. Элементтің реттік нөмірі осы элемент атомының ядросының зарядына тең болып шықты. Көптеген бұрын белгісіз элементтер периодтық жүйеде болжаған дәл сол қасиеттерді мақсатты іздеудің арқасында ашылды.
Д.И.Менделеевтің периодтық заңының маңызы ерекше. Ол қазіргі химияның негізін қалады, оны біртұтас, тұтас ғылымға айналдырды. Элементтер периодтық жүйеде қандай орын алатынына байланысты өзара байланыста қарастырыла бастады. Химия сипаттаушы ғылым болудан қалды. Периодтық заңның ашылуымен онда ғылыми болжау мүмкін болды. Жаңа элементтер мен олардың қосылыстарын болжау және сипаттау мүмкін болды. Оның жарқын мысалы Д.И.Менделеевтің өз заманында әлі ашылмаған элементтердің бар екендігі туралы болжамы, оның ішінде үшеуіне – Ga, Sc, Ge – олардың қасиеттеріне дәл сипаттама берді.
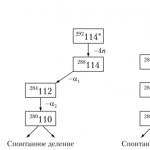
Д.И.Менделеев заңы негізінде оның жүйесінің Z=1-ден Z=92-ге дейінгі барлық бос ұяшықтары толтырылып, трансуран элементтері де ашылды. Ал бүгінде бұл заң жаңа химиялық элементтерді ашуға немесе жасанды түрде жасауға бағдар ретінде қызмет етеді. Сонымен, периодтық заңды басшылыққа ала отырып, егер Z=114 элементі синтезделсе, онда ол қорғасынның аналогы болады (ekaslead), Z=118 элементі синтезделсе, онда ол асыл газ болады деп айтуға болады. (экарадон).
Орыс ғалымы Н.А.Морозов ХІХ ғасырдың 80-жылдарында асыл газдардың болуын болжаған, содан кейін олар ашылған. Периодтық жүйеде олар периодтарды аяқтайды және VII топтың негізгі топшасын құрайды. «Периодтық заңға дейін, - деп жазды Д.И.Менделеев, - элементтер табиғаттың фрагменттік кездейсоқ құбылыстарын ғана білдірді; жаңасын күтуге негіз жоқ еді, ал жаңадан табылғандар мүлдем күтпеген жаңалық болды. Мерзімділік заңдылық бірінші рет әлі ашылмаған элементтерді осындай қашықтықта көруге мүмкіндік берді, бұл заңдылықпен қаруланбаған, осы уақытқа дейін жетпеген.
Периодтық заң элементтердің атомдық массаларын түзету үшін негіз болды. 20 элемент үшін Д.И.Менделеев атомдық массаларды түзетіп, содан кейін бұл элементтер периодтық жүйеде өз орындарын алды.
Д.И.Менделеевтің периодтық заңы мен периодтық жүйесі негізінде атом құрылысының теориясы қарқынды дамыды. Ол периодтық заңның физикалық мағынасын ашып, элементтердің периодтық жүйедегі орналасуын түсіндірді. Атом құрылысы туралы ілімнің дұрыстығы әрқашан периодтық заңмен тексерілген. Міне, тағы бір мысал. 1921 жылы Н.Бор 1870 жылы Д.И.Менделеев (экабор) болуын болжаған Z = 72 элементінің атомдық құрылымы цирконий (Zr - 2.8.18.10 . 2; a Hf - 2) болуы керек екенін көрсетті. 8. 18. 32. 10. 2), сондықтан оны цирконий минералдары арасынан іздеу керек. Осы кеңеске сүйене отырып, 1922 жылы венгр химигі Д.Хевеси мен голланд ғалымы Д.Костер норвегиялық цирконий рудасынан Z=72 элементін тауып, оны гафний деп атады (элемент ашылған жер Копенгагеннің латынша атауынан). Бұл атом құрылысы теориясының ең үлкен жеңісі болды: атомның құрылымы негізінде элементтің табиғатта орналасуы болжалды.
Атомдардың құрылысы туралы ілім атом энергиясын ашуға және оны адам қажеттіліктеріне пайдалануға әкелді. Периодтық заң ХХ ғасырдағы химия мен физиканың барлық жаңалықтарының бастапқы қайнар көзі деп айта аламыз. Ол химиямен байланысты басқа жаратылыстану ғылымдарының дамуында ерекше рөл атқарды.
Периодтық заң мен жүйе химия ғылымы мен өндірістің қазіргі мәселелерін шешудің негізінде жатыр. Д.И.Менделеевтің химиялық элементтерінің периодтық жүйесін ескере отырып, жаңа полимерлік және жартылай өткізгіш материалдар, ыстыққа төзімді қорытпалар, қажетті қасиеттері бар заттар алу, ядролық энергияны пайдалану үшін Жер мен Ғаламның түбірін пайдалану жұмыстары жүргізілуде.
Элементтердің периодтық жүйесі химияның кейінгі дамуына үлкен әсер етті.
Дмитрий Иванович Менделеев (1834-1907)
Бұл химиялық элементтердің когерентті жүйе құрайтынын және бір-бірімен тығыз байланыста екендігін көрсететін алғашқы табиғи жіктелуі ғана емес, сонымен бірге одан әрі зерттеудің қуатты құралы болды.
Менделеев өзі ашқан периодтық заң негізінде өз кестесін құрастырған кезде көптеген элементтер әлі белгісіз еді. Сонымен, төртінші периодтың элементі скандий белгісіз болды. Атомдық салмағы бойынша титан кальцийден кейін болды, бірақ титанды кальцийден кейін бірден орналастыру мүмкін емес еді, өйткені ол үшінші топқа жатады, ал титан ең жоғары оксидті құрайды және басқа қасиеттері бойынша төртінші топқа жатқызылуы керек. . Сондықтан Менделеев бір жасушаны өткізіп жіберді, яғни кальций мен титан арасында бос орын қалдырды. Дәл осы негізде төртінші кезеңде мырыш пен мышьяк арасында екі бос жасуша қалды, қазір галий мен германий элементтері орналасқан. Басқа қатарларда да бос орындар болды. Менделеев бұл орындарды толтыру үшін әлі белгісіз элементтер болуы керек екеніне көз жеткізіп қана қойған жоқ, сонымен қатар периодтық жүйенің басқа элементтерінің арасындағы орнын негізге ала отырып, мұндай элементтердің қасиеттерін алдын ала болжаған. Солардың бірі, келешекте кальций мен титанның арасында орын алуы керек еді, ол экабор деп атады (себебі оның қасиеттері борға ұқсауы керек еді); мырыш пен мышьяк арасындағы кестеде бос орындар болатын қалған екеуі эка-алюминий және эказилиций деп аталды.
Келесі 15 жыл ішінде Менделеевтің болжамдары тамаша расталды: барлық үш күтілетін элемент ашылды. Біріншіден, француз химигі Лекок де Бусборан экаалюминийдің барлық қасиеттеріне ие галлийді ашты; осыдан кейін экобор қасиеті бар скандийді Швецияда Л.Ф.Нильсон ашты, ақырында, тағы бірнеше жылдан кейін Германияда К.А.Винклер германий деп атаған элементті ашты, ол германиймен бірдей болып шықты. ecasilium.
Менделеев болжаудың таңғажайып дәлдігін бағалау үшін 1871 жылы ол болжаған эказиликонның қасиеттерін 1886 жылы ашылған германий қасиеттерімен салыстырайық:


Галий, скандий және германийдің ашылуы периодтық заңның ең үлкен жеңісі болды.
Периодтық жүйенің кейбір элементтердің валенттілігі мен атомдық массаларын анықтауда да маңызы зор болды. Осылайша, бериллий элементі бұрыннан алюминийдің аналогы болып саналды, ал оның оксидіне формула тағайындалды. Бериллий оксидінің пайыздық құрамы мен ұсынылған формуласына сүйене отырып, оның атомдық массасы 13,5-ке тең деп саналды. Периодтық жүйе бериллий үшін кестеде бір ғана орын бар екенін көрсетті, атап айтқанда магнийден жоғары, сондықтан оның оксидінің формуласы болуы керек , осыдан бериллийдің атомдық массасы онға тең. Бұл тұжырым көп ұзамай бериллийдің атомдық массасын оның хлоридінің буының тығыздығынан анықтау арқылы расталды.
Дәл және бүгінгі күні периодтық заң химияның жетекші бағыты және жетекші қағидасы болып қала береді. Оның негізінде соңғы онжылдықтарда ураннан кейінгі периодтық жүйеде орналасқан трансуран элементтері жасанды түрде жасалды. Солардың бірі – 1955 жылы алғаш рет алынған No 101 элемент – ұлы орыс ғалымының құрметіне менделевий деп аталды.
Периодтық заңның ашылуы және химиялық элементтер жүйесін құрудың тек химия үшін ғана емес, философия үшін де, дүниені бүкіл түсінуіміз үшін үлкен маңызы болды. Менделеев химиялық элементтердің табиғаттың негізгі заңына негізделген когерентті жүйені құрайтынын көрсетті. Бұл материалистік диалектиканың табиғат құбылыстарының өзара байланысы мен өзара тәуелділігі туралы ұстанымының көрінісі. Химиялық элементтердің қасиеттері мен олардың атомдарының массалары арасындағы байланысты аша отырып, периодтық заң табиғат дамуының әмбебап заңдарының бірі – санның сапаға ауысу заңының тамаша дәлелі болды.
Ғылымның кейінгі дамуы периодтық заңға сүйене отырып, Менделеев өмір сүрген кездегіден әлдеқайда тереңірек материяның құрылымын білуге мүмкіндік берді.
20 ғасырда дамыған атом құрылымының теориясы, өз кезегінде, периодтық заң мен элементтердің периодтық жүйесіне жаңа, тереңірек жарық берді. Менделеевтің мынадай пайғамбарлық сөздері тамаша растауды тапты: «Мерзімді заң жойылу қаупі жоқ, тек қондырма мен даму уәде етілген».
Кіріспе
Д.И.Менделеевтің периодтық заңының маңызы ерекше. Ол қазіргі химияның негізін қалады, оны біртұтас, тұтас ғылымға айналдырды. Элементтер периодтық жүйеде қандай орын алатынына байланысты өзара байланыста қарастырыла бастады. Н.Д.Зелинский атап көрсеткендей, периодтық заң «Әлемдегі барлық атомдардың өзара байланысының ашылуы» болды.
Химия сипаттаушы ғылым болудан қалды. Периодтық заңның ашылуымен онда ғылыми болжау мүмкін болды. Жаңа элементтер мен олардың қосылыстарын болжау және сипаттау мүмкін болды... Мұның жарқын мысалы Д.И.Менделеевтің өз заманында әлі ашылмаған элементтердің бар екендігі туралы болжамы, оның ішінде үшеуі үшін - Ga, Sc және Ge - ол. қасиеттеріне нақты сипаттама берді.
Периодтық жүйе және оның дүниенің ғылыми бейнесін түсінудегі маңызы
Д.И.Менделеев элементтерінің периодтық жүйесі, кестелік (немесе басқа графикалық) өрнек болып табылатын химиялық элементтердің табиғи жіктелуі Менделеевтің периодтық заңы. P. s. e. әзірлеген D.I. Менделеев 1869-1871 жж.
П.-ның тарихы. e.Химиялық элементтерді жүйелеу әрекеттерін 1930 жылдардан бастап Германия, Франция, Англия және АҚШ-тың әртүрлі ғалымдары жасады. Менделеевтің ізашары – И. Доберейнер, ЖӘНЕ. Дюма, француз химигі А.Шанкуртуа, ағылшын. химиктер В.Одлинг, Дж.Ньюлендс және басқалары химиялық қасиеттері бойынша ұқсас элементтер топтарының бар екенін анықтады, олар «табиғи топтар» деп аталады (мысалы, Доберейнер «триадасы»). Дегенмен, бұл ғалымдар топтар ішінде белгілі бір заңдылықтарды орнатудан әріге бармады. 1864 жылы Л. Мейератомдық салмақтар туралы мәліметтерге сүйене отырып, ол элементтердің бірнеше сипаттамалық топтары үшін атомдық салмақтардың қатынасын көрсететін кестені ұсынды. Мейер өз үстелінен теориялық есептерді шығарған жоқ.
Прототипі ғылыми П. с. e. Менделеев 1869 жылы 1 наурызда құрастырған «Элементтер жүйесінің атомдық салмағы мен химиялық ұқсастығына негізделген тәжірибесі» кестесі пайда болды. Келесі екі жыл ішінде автор бұл кестені жетілдірді, топтар, қатарлар және периодтар туралы идеяларды енгізді. элементтер; оның пікірінше, тиісінше 7 және 17 элементтерді қамтитын кіші және үлкен кезеңдердің сыйымдылығын бағалауға әрекет жасады. 1870 жылы ол өзінің жүйесін табиғи, ал 1871 жылы мерзімді деп атады. Сонда да П.-ның құрылымымен. e. заманауи формаға ие болды.
П.-ның бет эволюциясы үшін өте маңызды. e. Менделеевтің жүйедегі элементтің орны туралы енгізген идеясы болып шықты; элементтің орны период және топ сандарымен анықталады. Осы идеяны негізге ала отырып, Менделеев белгілі бір элементтердің (U, In, Ce және оның аналогтары) сол кезде қабылданған атомдық салмақтарын өзгерту қажет деген қорытындыға келді, бұл P.s-тің алғашқы практикалық қолданылуы болды. е., сонымен қатар алғаш рет P. s бос ұяшықтарына сәйкес келетін бірнеше белгісіз элементтердің бар болуы мен негізгі қасиеттерін болжады. e. Классикалық мысал - «экаалюминий» болжамы (болашақ Га, ашқан П. Лекок де Бусборан 1875 жылы), «экабора» (Sc, ашқан швед ғалымы Л. Нилсон 1879 ж.) және «эсилиенс» (Ге, ашқан неміс ғалымы К. Винклер 1886 жылы). Сонымен қатар, Менделеев марганец (болашақ Tc және Re), теллур (Po), йод (At), цезий (Fr), барий (Ra), тантал (Па) аналогтарының болуын болжаған.
P. s. e. іргелі ғылыми жалпылау ретінде бірден танылған жоқ; жағдай Ga, Sc, Ge ашылғаннан кейін және Be диваленттігі орнатылғаннан кейін ғана айтарлықтай өзгерді (ол ұзақ уақыт бойы үш валентті болып саналды). Соған қарамастан П. e. көп жағынан фактілердің эмпирикалық жалпылауын білдірді, өйткені периодтық заңның физикалық мағынасы түсініксіз болды және атомдық салмақтардың өсуіне байланысты элементтердің қасиеттерінің мерзімді өзгеруінің себептерін түсіндіру болмады. Сондықтан периодтық заңның физикалық негізделуіне және П.с теориясының дамуына дейін. e. көптеген фактілерді түсіндіру мүмкін болмады. Сонымен, 19 ғасырдың аяғында күтпеген жаңалық болды. инертті газдар, олар P.s.-де орын таппағандай болды. д.; бұл қиындық бетте P. қосудың арқасында жойылды. e. тәуелсіз нөлдік топ (кейіннен VIII а-кіші топтар). 20 ғасырдың басындағы көптеген «радио элементтердің» ашылуы. беттің П.-де оларды орналастыру қажеттілігі арасындағы қайшылыққа әкелді. e. және оның құрылымы (30-дан астам осындай элементтер үшін алтыншы және жетінші кезеңде 7 «бос» орын болды). Бұл қайшылық ашу арқылы жойылды изотоптар. Ақырында, элементтердің қасиеттерін анықтайтын параметр ретінде атомдық салмақтың (атомдық массаның) мәні бірте-бірте өзінің маңызын жоғалтты.
Периодтық заңның физикалық мағынасын түсіндіру мүмкін еместігінің негізгі себептерінің бірі және П. e. атом құрылысының теориясының жоқтығынан тұрды. Сондықтан П.-ның даму жолындағы ең маңызды кезең. e. атомның планетарлық моделі болды, оны Э. Рутерфорд(1911). Оның негізінде голланд ғалымы А.ван ден Брук (1913) элементтің реттік саны P. s. e. (атомдық нөмірі Z) сандық жағынан атом ядросының зарядына тең (элементар заряд бірлігінде). Мұны тәжірибе жүзінде растаған Г. Мозли(1913-14, қараңыз Мосли заңы). Сонымен, элементтердің қасиеттерінің өзгеруінің периодтылығы атом салмағына емес, атом санына байланысты екенін анықтауға болады. Нәтижесінде ғылыми негізде P.s төменгі шегі анықталды. e. (минимум Z = 1 элемент ретінде сутегі); сутегі мен уран арасындағы элементтердің саны дәл есептелді; беттің П.-де «бос орындар» екені анықталды. e. Z = 43, 61, 72, 75, 85, 87 болатын белгісіз элементтерге сәйкес келеді.
Алайда, сирек жер элементтерінің нақты саны туралы мәселе түсініксіз болып қалды, және (бұл әсіресе маңызды) элементтердің Z-ге байланысты қасиеттерінің периодты өзгеруінің себептері ашылмады.Бұл себептер одан әрі зерттеу барысында табылды. П.с теориясының дамуы. e. атомның құрылымы туралы кванттық идеяларға негізделген (төменде қараңыз). Периодтық заңның физикалық негізделуі және изотония құбылысының ашылуы «атомдық масса» («атомдық салмақ») ұғымын ғылыми тұрғыдан анықтауға мүмкіндік берді. Қосылған периодтық кестеде 1973 жылғы Халықаралық кестеге сәйкес көміртегі шкаласы бойынша элементтердің атомдық массаларының қазіргі мәндері бар. Радиоактивті элементтердің ең ұзақ өмір сүретін изотоптарының массалық сандары төртбұрышты жақшада берілген. Ең тұрақты 99 Tc, 226 Ra, 231 Pa және 237 Np изотоптарының массалық сандарының орнына Атомдық салмақтар жөніндегі халықаралық комиссия қабылдаған (1969) осы изотоптардың атомдық массалары келтірілген.
П.-ның құрылымы. e.Қазіргі (1975) P. с. e. 106 химиялық элементтерді қамтиды; оның ішінде барлық трансуран (Z = 93-106), сонымен қатар Z = 43 (Tc), 61 (Pm), 85 (At) және 87 (Fr) элементтері жасанды жолмен алынды. П.с.-ның бүкіл тарихы үшін. e. оның графикалық бейнеленуінің көптеген нұсқалары (бірнеше жүздеген) ұсынылды, негізінен кестелер түрінде; бейнелер әртүрлі геометриялық фигуралар (кеңістіктік және жазық), аналитикалық қисық (мысалы, спиральдар) түрінде де белгілі. Ең кең тарағандары - P. s-тің үш түрі. е .: қысқаша, Менделеев ұсынған және жалпыға бірдей мойындалған; ұзын баспалдақ. Ұзын пішінді де Менделеев дамытты, ал жетілдірілген түрде оны 1905 жылы А. Вернер. Баспалдақ формасын ағылшын ғалымы Т.Бэйли (1882), дат ғалымы Дж.Томсен (1895) ұсынып, Н. Бором(1921). Үш форманың әрқайсысының артықшылықтары мен кемшіліктері бар. П.-ны құрудың негізгі принципі. e. барлық химиялық элементтердің топтарға және периодтарға бөлінуі болып табылады. Әр топ өз кезегінде негізгі (а) және қосалқы (б) топшаларға бөлінеді. Әрбір топшада ұқсас химиялық қасиеттері бар элементтер бар. Элементтер А- Және б- әрбір топтағы топшалар, әдетте, бір-бірінен белгілі бір химиялық ұқсастықты көрсетеді, негізінен жоғары тотығу дәрежелерінде, әдетте, топ нөміріне сәйкес келеді. Период – сілтілік металдан басталып, инертті газбен аяқталатын элементтер жиынтығы (ерекше жағдай – бірінші период); Әрбір кезең элементтердің қатаң анықталған санын қамтиды. P. s. e. 8 топ пен 7 кезеңнен тұрады (жетіншісі әлі аяқталған жоқ).
Бірінші периодтың ерекшелігі оның құрамында тек 2 элемент бар: H және He. Жүйедегі Н орны анық емес: ол сілтілі металдар мен галогендерге ортақ қасиеттерді көрсететіндіктен, ол не I-де орналасады. а-, немесе (дұрысы) VII а-кіші топ. Гелий - VII бірінші өкілі а- топшалар (бірақ ұзақ уақыт бойы Ол және барлық инертті газдар тәуелсіз нөлдік топқа біріктірілді).
Екінші период (Li - Ne) 8 элементтен тұрады. Ол жалғыз тотығу дәрежесі I болатын сілтілік металдан Li басталады. Содан кейін Be, металл, тотығу дәрежесі II келеді. Келесі В элементінің металдық табиғаты әлсіз өрнектелген (тотығу дәрежесі III). Одан кейінгі C типтік бейметалл, ол оң және теріс тетравалентті болуы мүмкін. Одан кейінгі N, O, F және Ne металдар емес, тек N тобының нөміріне сәйкес келетін ең жоғары тотығу дәрежесі V болады; оттегі сирек жағдайларда ғана оң валенттілігін көрсетеді, ал F үшін VI тотығу дәрежесі белгілі. Периодты не инертті газ аяқтайды.
Үшінші период (Na - Ar) да 8 элементтен тұрады, олардың қасиеттерінің өзгеру сипаты екінші периодта байқалғанға ұқсас. Алайда, Mg, Be-ден айырмашылығы, В-мен салыстырғанда Al сияқты металдық болып табылады, бірақ Al табиғаты бойынша амфотерлік. Si, P, S, Cl, Ar типтік бейметалдар, бірақ олардың барлығы (Ar-дан басқа) топ нөміріне тең жоғары тотығу дәрежесін көрсетеді. Осылайша, екі кезеңде де Z жоғарылаған сайын элементтердің металдық қасиетінің әлсіреуі және бейметалдық табиғатының күшеюі байқалады. Менделеев екінші және үшінші периодтың элементтерін (өз терминологиясында шағын) типтік деп атады. Олардың табиғатта ең көп тарағандары, ал C, N және O, Н-мен бірге органикалық заттардың (органогендердің) негізгі элементтері болып табылатыны маңызды. Алғашқы үш кезеңнің барлық элементтері кіші топтарға кіреді А .
Қазіргі терминологияға сәйкес (төменде қараңыз), бұл кезеңдердің элементтері жатады с-элементтер (сілтілік және сілтілі жер металдар), I құрайтын а- және II аішкі топтар (түстер кестесінде қызыл түспен белгіленген) және Р-элементтер (B - Ne, At - Ar) III-ке кіреді а- VIII а-топшалар (олардың таңбалары қызғылт сары түспен белгіленген). Кішігірім кезеңдердің элементтері үшін сериялық нөмірлердің өсуімен алдымен төмендеу байқалады атом радиустары, содан кейін атомның сыртқы қабатындағы электрондар саны қазірдің өзінде айтарлықтай артқанда, олардың өзара тебілуі атом радиустарының ұлғаюына әкеледі. Келесі максимумға сілтілі элементте келесі кезеңнің басында жетеді. Шамамен бірдей заңдылық иондық радиустарға тән.
Төртінші период (К - Кр) 18 элементтен тұрады (Менделеев бойынша бірінші үлкен период). Сілтілік метал К және сілтілі жер Са (s-элементтер) қатарынан он деп аталатын қатар келеді. өтпелі элементтер(Sc - Zn), немесе d-ішкі топтарға кіретін элементтер (таңбалар көк түспен берілген). ббеттің P. сәйкес топтары. e. Көптеген өтпелі элементтер (олардың барлығы металдар) топ нөміріне тең жоғары тотығу дәрежесін көрсетеді. Ерекшелік - Fe - Co - Ni триадасы, мұнда соңғы екі элемент максималды оң үш валентті, ал белгілі бір жағдайларда темір VI тотығу дәрежесінде белгілі. Ga-дан Kr-ға дейінгі элементтер ( Р-элементтер), ішкі топтарға жатады А, ал олардың қасиеттерінің өзгеру сипаты екінші және үшінші период элементтері үшін сәйкес Z интервалдарындағыдай. Kr химиялық қосылыстар (негізінен F-мен) түзуге қабілетті екені анықталды, бірақ ол үшін VIII тотығу дәрежесі белгісіз.
Бесінші период (Rb - Xe) төртіншіге ұқсас құрастырылған; оның сонымен қатар 10 өтпелі элементтің кірістіруі бар (Y - Cd), г-элементтер. Периодтың ерекше белгілері: 1) Ru - Rh - Pd триадасында тек рутений VIII тотығу дәрежесін көрсетеді; 2) а топшаларының барлық элементтері топ нөміріне тең ең жоғары тотығу дәрежелерін көрсетеді, оның ішінде Xe; 3) Менде әлсіз металлдық қасиеттер бар. Осылайша, төртінші және бесінші период элементтері үшін Z артқан сайын қасиеттердің өзгеру сипаты күрделірек, өйткені металлдық қасиеттер сериялық нөмірлердің үлкен диапазонында сақталады.
Алтыншы период (Cs - Rn) 32 элементті қамтиды. Қосымша 10 г-элементтер (La, Hf - Hg) 14 жиынын қамтиды f-элементтер, лантанидтер, Цеден Луға дейін (қара түстегі кейіпкерлер). Ла-Лу элементтері химиялық жағынан өте ұқсас. Қысқаша айтқанда P. s. e. лантанидтер La қорапшасына енгізілген (өйткені олардың басым тотығу дәрежесі III) және кестенің төменгі жағындағы бөлек жолда көрсетілген. Бұл әдіс біршама ыңғайсыз, өйткені 14 элемент кестеден тыс сияқты. Ұзын және баспалдақ нысандары P. беттің ұқсас жетіспеушілігінен айырылған. е., P.s интегралдық құрылымының фонында лантанидтердің ерекшеліктерін жақсы көрсетеді. e. Периодтың ерекшеліктері: 1) Os - Ir - Pt триадасында VIII тотығу дәрежесін тек осмий көрсетеді; 2) Ат неғұрлым айқын (1-ге қарағанда) металдық сипатқа ие; 3) Rn, шамасы (оның химиясы аз зерттелген), инертті газдардың ең реактивті болуы керек.
Fr (Z = 87) бастап жетінші периодта да 32 элемент болуы керек, оның әзірге 20 элементі белгілі (Z = 106 элементке дейін). Fr және Ra - сәйкесінше I элементтері а- және II а-топшалар (s-элементтер), Ac - элементтердің аналогы III б-кіші топтар ( г-элемент). Келесі 14 элемент, f-элементтер (Z 90-нан 103-ке дейін), отбасын құрайды актинидтер. Қысқаша айтқанда P. s. e. олар Ac ұяшығын алады және лантанидтер сияқты кестенің төменгі жағында бөлек жолға жазылады, олардан айырмашылығы олар тотығу күйлерінің айтарлықтай әртүрлілігімен сипатталады. Осыған байланысты лантанидтер мен актинидтер қатары химиялық тұрғыдан айтарлықтай айырмашылықтарды көрсетеді. Z = 104 және Z = 105 болатын элементтердің химиялық табиғатын зерттеу бұл элементтердің сәйкесінше гафний мен танталдың аналогтары екенін көрсетті, яғни г-элементтер, және IV-ге орналастырылуы керек б- және В б-кіші топтар. Мүшелер б-ішкі топтарда Z = 112-ге дейінгі келесі элементтер болуы керек, содан кейін (Z = 113-118) пайда болады Р-элементтер (III а- VIll а-кіші топтар).
П. теориясымен. e.П.-ның бет теориясының негізінде. e. Z ұлғайған сайын атомдардағы электронды қабаттардың (қабаттардың, деңгейлердің) және ішкі қабаттардың (қабықтардың, ішкі деңгейлердің) құрылысының нақты заңдылықтары туралы идея жатыр. e. және олардың атомдық спектрлерін зерттеу нәтижелері. Бор атомдардың электрондық конфигурациясының қалыптасуының үш маңызды ерекшелігін ашты: 1) электронды қабықшаларды толтыру (негізгі мәндерге сәйкес келетін қабықтарды қоспағанда). кванттық сан n= 1 және 2) олардың толық сыйымдылығына дейін монотонды түрде болмайды, бірақ үлкен мәндері бар қабықтарға жататын электрондар жиындарының пайда болуымен үзіледі. n; 2) атомдардың электрондық конфигурацияларының ұқсас түрлері кезеңді түрде қайталанады; 3) P. с кезеңдерінің шекаралары. e. (бірінші және екіншісін қоспағанда) кезекті электронды қабаттардың шекараларымен сәйкес келмейді.
P.-ның мәні. e. P. s. e. жаратылыстану ғылымдарының дамуында орасан зор рөл атқарды және атқаруда. Бұл атом-молекулалық ғылымның ең маңызды жетістігі болды, «химиялық элемент» ұғымына қазіргі заманғы анықтама беруге және жай заттар мен қосылыстар туралы түсініктерді нақтылауға мүмкіндік берді. P.s ашқан үлгілер. е., атомдардың құрылысы теориясының дамуына елеулі әсер етті, изотония құбылысын түсіндіруге ықпал етті. РАҚМЕТ. e. Химиядағы болжау мәселесінің қатаң ғылыми тұжырымы байланысты, ол белгісіз элементтердің және олардың қасиеттерінің болуын болжауда да, бұрыннан ашылған элементтердің химиялық әрекетінің жаңа белгілерін болжауда да көрінді. P. s. д.- химияның негізі, ең алдымен бейорганикалық; ол алдын ала анықталған қасиеттері бар заттарды синтездеу, жаңа материалдарды, атап айтқанда жартылай өткізгіш материалдарды әзірлеу, әртүрлі химиялық процестер үшін нақты катализаторларды таңдау және т.б. мәселелерін шешуге айтарлықтай көмектеседі. P. s. д., сонымен қатар химияны оқытудың ғылыми негізі болып табылады.
Қорытынды
Д.И.Менделеевтің периодтық жүйесі атом және молекулалық ғылымның дамуындағы маңызды кезең болды. Оның арқасында химиялық элемент туралы заманауи түсінік қалыптасты, қарапайым заттар мен қосылыстар туралы түсініктер нақтыланды.
Менделеевтің өзі көрсеткен периодтық жүйенің болжамдық рөлі 20 ғасырда трансуран элементтерінің химиялық қасиеттерін бағалауда көрінді.
Периодтық жүйенің пайда болуы химия және бірқатар оған байланысты ғылымдар тарихында жаңа, шын мәнінде ғылыми дәуірді ашты - элементтер мен қосылыстар туралы шашыраңқы мәліметтердің орнына үйлесімді жүйе пайда болды, оның негізінде жалпылау мүмкін болды, қорытынды жасау, болжау.
Менделеев атомының периодтық заңы
Периодтық заң химиядағы көптеген ғылыми ақпаратты жүйеге енгізуге және жалпылауға мүмкіндік берді. Заңның бұл функциясы интегративті деп аталады. Ол әсіресе химияның ғылыми және оқу материалын құрылымдауда айқын көрінеді. Академик А.Е.Ферсман бұл жүйе барлық химияны біртұтас кеңістіктік, хронологиялық, генетикалық, энергетикалық байланыс шеңберінде біріктіретінін айтты.
Периодтық заңның интегративті рөлі жалпы заңдылықтан шығып кеткен элементтер туралы кейбір мәліметтерді автордың өзі де, оның ізбасарлары да тексеріп, нақтылауынан да көрінді.
Бұл бериллийдің ерекшеліктерімен болды. Менделеевтің жұмысына дейін диагональды ұқсастық деп аталатынына байланысты алюминийдің үш валентті аналогы болып саналды. Осылайша, екінші кезеңде бір екі валентті элемент емес, екі үш валентті элемент болды. Дәл осы кезеңде, ең алдымен психикалық модельдік конструкциялар деңгейінде, Менделеев бериллийдің қасиеттерін зерттеудегі қателіктен күдіктенді. Содан кейін ол бериллий екі валентті және атомдық салмағы 9-ға тең деп есептейтін орыс химигі Авдеевтің еңбегін тапты. Авдеевтің еңбегін ғылым әлемі назардан тыс қалдырды, автор өте улы бериллий қосылыстарымен уланып өлсе керек. Авдеев зерттеулерінің нәтижелері периодтық заңның арқасында ғылымда орнықты.
Атомдық салмақтардың да, валенттіліктердің де мәндерінің мұндай өзгерістері мен нақтылануын Менделеев тағы тоғыз элементке (In, V, Th, U, La, Ce және басқа үш лантанидтер) жасады. Тағы он элементте тек атомдық салмақ түзетілді. Және бұл нақтылаулардың барлығы кейіннен тәжірибе жүзінде расталды.
Сол сияқты Карл Карлович Клаустың жұмысы Менделеевке элементтердің триадаларындағы көлденең және тік ұқсастықтарды түсіндіре отырып, VIII элементтер тобының бір түрін құруға көмектесті:
темір кобальт никель
Рутений Родий Палладий
октий иридий платина
Периодтық заңның болжамдық (болжау) функциясы 21, 31 және 32 реттік нөмірлері бар белгісіз элементтерді ашуда ең жарқын растауды алды. Олардың бар болуы алдымен интуитивті деңгейде болжанған, бірақ жүйенің қалыптасуымен Менделеев болды. олардың қасиеттерін жоғары дәлдікпен есептей алады. Скандий, галлий және германийдің ашылуының әйгілі тарихы Менделеевтің ашылуының салтанаты болды. Ф.Энгельс былай деп жазды: «Санның сапаға ауысуы туралы гегельдік заңды санасыз түрде қолдана отырып, Менделеев белгісіз Нептун планетасының орбитасын есептеген Лаверьердің ашқан жаңалығымен қатар қоюға болатын ғылыми ерлік жасады». Дегенмен, классикпен айтысуға құштарлық бар. Біріншіден, Менделеевтің студенттік кезінен бастап барлық зерттеулері саналы түрде гегельдік заңға сүйенді. Екіншіден, Лаверьер Нептунның орбитасын Ньютонның бұрыннан белгілі және дәлелденген заңдары бойынша есептеді, ал Д.И.Менделеев барлық болжамдарды өзі ашқан жалпыға бірдей табиғат заңы негізінде жасады.
Менделеев өмірінің соңында: «1871 жылы әлі ашылмаған элементтердің қасиеттерін анықтауда периодтық заңның қолданылуы туралы мақала жазғанда, мен бұл салдарды ақтау үшін өмір сүремін деп ойламадым. периодтық заң, бірақ шындық басқаша жауап берді. Мен үш элементті сипаттадым: экабор, экаалюминий және эксилиций, және 20 жылдан аз уақыттан кейін мен үшеуін де ашқанды көргенде үлкен қуанышқа бөлендім... Л.де Бойсбодран, Нильсон және Винклер, өз тарапымнан, мен оны шынайы күшейтуші деп санаймын. периодтық заң. Олар болмаса, қазіргідей дәрежеде танылмас еді». Барлығы Менделеев он екі элементті болжаған.
Менделеев ең басынан бастап заң химиялық элементтердің өздерінің ғана емес, сонымен қатар олардың көптеген қосылыстарының, соның ішінде осы уақытқа дейін белгісіздердің қасиеттерін сипаттайтынын көрсетті. Мұны растау үшін мысал келтірсек те жеткілікті. Академик П.Л.Капица германийдің металл емес өткізгіштігін алғаш ашқан 1929 жылдан бастап әлемнің барлық елдерінде жартылай өткізгіштер теориясының дамуы басталды. Осындай қасиеттері бар элементтер IV топтың негізгі топшасын алатыны бірден белгілі болды. Уақыт өте келе, осы топтан бірдей қашықтықта орналасқан периодтарда орналасқан элементтер қосылыстары (мысалы, AzB сияқты жалпы формуласы бар;) көп немесе аз дәрежеде жартылай өткізгіштік қасиеттерге ие болуы керек деген түсінік пайда болды. Бұл жаңа практикалық маңызды жартылай өткізгіштерді іздеуді бірден мақсатты және болжамды етті. Қазіргі заманғы электрониканың барлығы дерлік осындай қосылыстарға негізделген.
Периодтық жүйе шеңберіндегі болжамдар оны жалпыға бірдей мойындағаннан кейін де жасалғанын атап өткен жөн. 1913 жылы Мозе-ли әртүрлі элементтерден жасалған антикатодтардан алынатын рентген сәулелерінің толқын ұзындығының Периодтық жүйедегі элементтерге шартты түрде берілген сериялық нөмірге байланысты тұрақты түрде өзгеретінін анықтады. Эксперимент элементтің атомдық нөмірі тікелей физикалық мағынаға ие екенін растады. Тек кейінірек сериялық нөмірлер ядроның оң зарядының мәнімен байланысты болды. Екінші жағынан, Мозели заңы периодтардағы элементтердің санын бірден тәжірибе жүзінде растауға және сонымен бірге гафний (No72) мен ренийдің (No75) әлі анықталмаған орындарын болжауға мүмкіндік берді. сол кезде ашылған.
Мозлидің дәл осындай зерттеулері Менделеевке атомдық массалар кестесіндегі элементтердің дұрыс қатарынан белгілі бір ауытқулар берген ауыр «бас ауруын» жоюға мүмкіндік берді. Менделеев оларды химиялық ұқсастықтардың қысымымен, ішінара сарапшылық деңгейде, ішінара интуитивтік деңгейде жасады. Мысалы, кобальт кестеде никельден алда болды, ал атомдық салмағы төмен йод ауыр теллурдан кейін болды. Ең әдемі теорияның шеңберіне сыймайтын бір «шіркін» факті оны бұзатыны жаратылыстану ғылымында бұрыннан белгілі. Сол сияқты, түсініксіз ауытқулар Периодтық заңға қауіп төндірді. Бірақ Мозели тәжірибе жүзінде кобальттың (No27) және никельдің (No28) сериялық нөмірлері олардың жүйедегі орнына дәл сәйкес келетінін дәлелдеді. Бұл ерекшеліктер тек жалпы ережені растайтыны белгілі болды.
Маңызды болжамды 1883 жылы Николай Александрович Морозов жасады. «Народная воля» қозғалысына қатысқаны үшін химия факультетінің студенті Морозов өлім жазасына кесілді, кейінірек бір адамдық камерада өмір бойына бас бостандығынан айырылды. Ол отыз жылдай патша түрмелерінде болды. Шлиссельбург бекінісінің тұтқыны химия бойынша кейбір ғылыми әдебиеттерді алуға мүмкіндік алды. Периодтық жүйедегі элементтердің көршілес топтары арасындағы атомдық салмақтардың интервалдарын талдау негізінде Морозов галогендер мен сілтілер топтары арасында «нөлдік қасиеттері» белгісіз элементтердің басқа тобының болуы мүмкіндігі туралы интуитивті қорытындыға келді. металдар. Оларды ауаның құрамынан іздеуді ұсынды. Оның үстіне ол атомдардың құрылысы туралы гипотезаны алға тартты және оның негізінде элементтердің қасиеттеріндегі периодтылықтың себептерін ашуға тырысты.
Алайда, Морозовтың гипотезалары талқылау үшін қол жетімді болды, ол 1905 жылғы оқиғалардан кейін босатылған кезде. Бірақ бұл уақытқа дейін инертті газдар ашылған және зерттелген болатын.
Ұзақ уақыт бойы инертті газдардың болуы фактісі және олардың периодтық жүйедегі орны химиялық әлемде елеулі дау тудырды. Менделеевтің өзі біраз уақыт Nj типті белгісіз жай затты ашылған аргонның атымен жасыруға болады деп есептеді. Инертті газдардың орны туралы алғашқы ұтымды болжамды олардың ашылуының авторы Уильям Рамсей жасады. Ал 1906 жылы Менделеев былай деп жазды: «Периодтық жүйе (18б9) құрылған кезде, аргон белгілі болған жоқ, сонымен қатар мұндай элементтердің болуы мүмкіндігіне күмәндануға негіз болмады. Бүгінгі күні ... бұл элементтер атомдық салмақтары бойынша галогендер мен сілтілі металдар арасында дәл орын алды.
Ұзақ уақыт бойы дау болды: инертті газдарды элементтердің тәуелсіз нөлдік тобына бөлу немесе оларды VIII топтың негізгі топшасы деп санау. Әрбір көзқарастың оң және теріс жақтары бар.
Периодтық жүйедегі элементтердің орнына сүйене отырып, Линус Полинг басқарған теориялық химиктер олардың фторидтері мен оксидтерінің ықтимал тұрақтылығын тікелей көрсете отырып, инертті газдардың толық химиялық пассивтілігіне ұзақ уақыт күмән келтірді. Бірақ тек 1962 жылы американдық химик Нил Бартлетт алғаш рет платина гексафторидінің оттегімен ең қарапайым жағдайларда реакциясын жүргізіп, ксенон гексафтороплатинаты XePtF ^ және одан кейін қазіргі уақытта дұрысырақ асыл деп аталатын басқа газ қосылыстарын алды. инертті қарағанда.
Периодтық заң өзінің болжау қызметін осы күнге дейін сақтап келеді.
Айта кету керек, кез келген жиынның белгісіз мүшелерінің болжамдары екі түрлі болуы мүмкін. Ұқсастардың белгілі қатарында болатын элементтің қасиеттері болжанса, онда мұндай болжау интерполяция деп аталады. Бұл қасиеттер көрші элементтердің қасиеттері сияқты заңдарға бағынады деп болжауға болатыны заңды. Периодтық жүйедегі жетіспейтін элементтердің қасиеттері осылай болжалды. Жаңа жиын мүшелерінің сипаттамаларын болжау әлдеқайда қиын, егер олар сипатталған бөліктен тыс болса. Экстраполяция - белгілі үлгілер жиынтығынан тыс функция мәндерін болжау - әрқашан азырақ сенімді.
Жүйенің белгілі шекарасынан тыс элементтерді іздестіру басталған кезде ғалымдардың алдында осы мәселе тұрды. ХХ ғасырдың басында. периодтық кесте уранмен аяқталды (No 92). Трансуран элементтерін алудың алғашқы әрекеттері 1934 жылы Энрико Ферми мен Эмилио Сегре уранды нейтрондармен бомбалаған кезде жасалды. Осылайша актиноидтар мен трансактиноидтарға жол басталды.
Ядролық реакциялар басқа бұрын белгісіз элементтерді синтездеу үшін де қолданылады.
Йеен Теодор Сиборг пен оның әріптестері жасанды түрде синтездеген №101 элемент Менделевий деп аталды. Бұл туралы Сиборгтың өзі былай деді: «Әсіресе, 101 элементті орыстың ұлы химигі Д.И.Менделеевті химияның пионері деп санайтын америкалық ғалымдардың есімімен атағанын ерекше атап өткен жөн».
Жаңадан ашылған, дәлірек айтсақ, жасанды түрде жасалған элементтердің саны үнемі өсіп келеді. Атомдық нөмірлері 113 және 115 болатын элементтердің ең ауыр ядроларының синтезі Дубнадағы Ресейдің Біріккен ядролық зерттеулер институтында ауыр кальций-48 изотопының ядроларымен жасанды алынған америцийдің ядроларын бомбалау арқылы жүзеге асырылды. Бұл жағдайда №115 элементтің ядросы пайда болады, ол бірден № 113 элементтің ядросының түзілуімен ыдырайды. Мұндай аса ауыр элементтер табиғатта жоқ, бірақ олар суперновалық жарылыстар кезінде пайда болады, сонымен қатар № 113 элементтің ядросы пайда болған кезде де болуы мүмкін. Үлкен жарылыс. Оларды зерттеу біздің ғаламның қалай пайда болғанын түсінуге көмектеседі.
Табиғатта барлығы 39 табиғи радиоактивті изотоптар кездеседі. Әртүрлі изотоптар әртүрлі жылдамдықпен ыдырайды, бұл жартылай ыдырау периодымен сипатталады. Уран-238 жартылай ыдырау периоды 4,5 миллиард жыл, ал кейбір басқа элементтер үшін секундтың миллионнан бір бөлігіне тең болуы мүмкін.
Радиоактивті элементтер ретімен ыдырап, бір-біріне айнала отырып, тұтас қатарларды құрайды. Мұндай үш қатар белгілі: бастапқы элемент бойынша қатардың барлық мүшелері уран, актиноураний және торий тұқымдастарына біріктірілген. Басқа бір отбасы жасанды жолмен алынған радиоактивті изотоптардан тұрады. Барлық отбасыларда трансформациялар радиоактивті емес қорғасын атомдарының түзілуімен аяқталады.
Жер қыртысында жартылай ыдырау периоды Жердің жасына сәйкес келетін изотоптарды ғана табуға болатындықтан, оның миллиардтаған жылдар тарихында сондай қысқа өмір сүретін изотоптар да болған деп болжауға болады. енді сөздің тура мағынасында жойылды. Олардың ішінде калий-40 ауыр изотопы болуы мүмкін. Оның толық ыдырауының нәтижесінде калийдің атомдық массасының кестелік мәні бүгінгі күні 39,102-ге тең, сондықтан ол массасы бойынша No18 аргон элементінен (39,948) төмен. Бұл периодтық жүйедегі элементтердің атомдық массаларының дәйекті ұлғаюындағы ерекшеліктерді түсіндіреді.
Академик В.И. Гольданский Менделеевті еске алуға арналған сөзінде «периодтық жүйенің тамаша жасаушысы қайтыс болғаннан кейін ондаған жылдар өткен соң пайда болған химияның мүлдем жаңа салаларында Менделеевтің еңбектерінің атқаратын іргелі рөлін» атап өтті.
Ғылым – ғасырлар даналығы мен тәжірибесінің тарихы мен қоймасы, олардың парасатты ойлары мен сындарлы пайымдаулары.
Д.И.Менделеев
Ғылыми жаңалықтың мүлдем күтпеген нәрсеге айналуы сирек кездеседі, ол әрқашан күтіледі:
дегенмен, барлық сұрақтарға сыналған жауаптарды қолданатын кейінгі ұрпақтар үшін олардың алдындағыларға қаншалықты қиын болғанын түсіну қиын.
C. Дарвин
Бізді қоршаған дүние туралы ғылымдардың әрқайсысының материя қозғалысының нақты формаларын зерттеу пәні бар. Үстем идеялар қозғалыстың бұл формаларын олардың күрделілігін арттыру тәртібімен қарастырады:
механикалық – физикалық – химиялық – биологиялық – әлеуметтік. Келесі формалардың әрқайсысы алдыңғыларды жоққа шығармайды, бірақ оларды қамтиды.
Периодтық заңның ашылуының жүз жылдығын мерекелеуде Г.Т.Сиборг өзінің баяндамасын химияның соңғы жетістіктеріне арнауы кездейсоқ емес. Онда ол орыс ғалымының таңғажайып еңбегін жоғары бағалады: «Менделеев заманынан бергі периодтық жүйенің эволюциясын қарастырғанда, ең әсерлі әсер оның Элементтердің периодтық жүйесін жасай алғандығы, бірақ Менделеевтің ядролық құрылым және изотоптар, сериялық нөмірлердің валенттілікпен байланысы, атомдардың электрондық табиғаты, электронды құрылыммен түсіндірілетін химиялық қасиеттердің периодтылығы және ең соңында радиоактивтілік сияқты қазіргі кезде жалпы қабылданған ұғымдарды біледі.
Болашаққа назар аударған академик А.Е.Ферсманның сөзін келтіруге болады: «Жаңа теориялар, тамаша жалпылаулар пайда болады және өледі. Жаңа идеялар атом мен электрон туралы ескірген ұғымдарымызды алмастырады. Ең үлкен ашылулар мен эксперименттер өткенді жоққа шығарады және бүгінгі күн үшін керемет жаңалық пен кеңдіктің көкжиектерін ашады - мұның бәрі келеді және кетеді, бірақ Менделеевтің периодтық заңы әрқашан өмір сүреді және ізденістерге бағыт береді.